题目内容
在温度不变的条件下,密闭容器中发生如下反应:2SO2(g)+O2(g)
2SO3(g)下列叙述能够说明反应已经达到平衡状态的是( )
| V2O5 |
| 500℃ |
| A、容器中SO2、O2、SO3共存 |
| B、SO2 与SO3的浓度相等 |
| C、反应容器中压强不随时间变化 |
| D、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断,
A、无论是否达到平衡状态都存在三种物质共存;
B、各物质的浓度大小关系取决于起始量与转化的程度,不能作为判断达到平衡的依据;
C、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的浓度不变,导致容器中压强不随时间的变化而改变;
D、各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据.
A、无论是否达到平衡状态都存在三种物质共存;
B、各物质的浓度大小关系取决于起始量与转化的程度,不能作为判断达到平衡的依据;
C、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的浓度不变,导致容器中压强不随时间的变化而改变;
D、各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据.
解答:
解:反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,
A、该反应为可逆反应,无论是否达到平衡状态都存在三种物质共存的特点,故A错误;
B、平衡时各物质的浓度大小关系取决于起始量与转化的程度,不能作为判断达到平衡的依据,故B错误;
C、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的浓度不变,导致容器中压强不随时间的变化而改变,故C正确;
D、平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故D错误;
故选C.
A、该反应为可逆反应,无论是否达到平衡状态都存在三种物质共存的特点,故A错误;
B、平衡时各物质的浓度大小关系取决于起始量与转化的程度,不能作为判断达到平衡的依据,故B错误;
C、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的浓度不变,导致容器中压强不随时间的变化而改变,故C正确;
D、平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故D错误;
故选C.
点评:本题考查化学平衡状态的判断,题目难度不大,注意把握判断的角度以及平衡状态的特征,易错点为B、C,注意体会.

练习册系列答案
相关题目
反应:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)已达平衡.若增大压强,平衡移动,但混合气体的平均相对分子质量不变.下列说法正确的是( )
| A、原混合气体的平均相对分子质量为30 |
| B、原混合气体的平均相对分子质量为28 |
| C、起始时,NH3与CO2的体积比为13:14 |
| D、起始时,NH3与CO2的体积比为14:15 |
用98%浓硫酸配制200mL 0.5mol?L-1的硫酸溶液,一定需要使用的玻璃仪器是①玻璃棒 ②烧杯 ③烧瓶 ④量筒 ⑤容量瓶( )
| A、①②③ | B、①②④⑤ |
| C、②③⑤ | D、③④⑤ |
一定温度下,对固定容器中的可逆反应A(g)+2B(g)?3C(g)的下列叙述中,能说明反应已达到平衡的是( )(A、B为无色气体,C为有色气体)
| A、混合气体的物质的量不再变化 |
| B、单位时间内消耗amolA,同时生成3amolC |
| C、容器内的压强不再变化 |
| D、容器内气体颜色不再变化 |
对于任何一个化学平衡体系,采取下列措施一定会使平衡发生移动的是( )
| A、加入一种反应物 |
| B、增大体系的压强 |
| C、升高温度 |
| D、使用催化剂 |
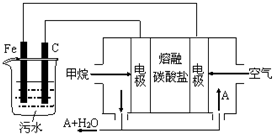 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.