题目内容
11.水合碱式碳酸镁[4MgCO3•Mg(OH)2•4H2O〕,又称轻质碳酸镁.常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%〕碳化法制取: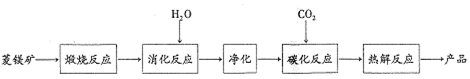
(1)根据下列表格数据,选择消化反应的最佳温度70℃;理由是温度进一步升高同等幅度,转化率几乎不变,但能耗增加.
| 消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(3)流程图中煅烧反应和热解反应可以为碳化反应提供二氧化碳源.
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5时,可以认为完全除去.常温时当调节溶液pH为9.5时,此时Mn2+小于10-5mol/L,不会沉淀出来.
| 物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
A.Ca(C1O)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为方案2,理由是加入碳酸钠的产品中易混入更多杂质,不易提纯.

分析 菱镁矿(质量含量为碳酸镁90%,碳酸钙10%〕碳化法制取水合碱式碳酸镁[4MgC03•Mg(OH)2•4H2O〕,将菱镁矿煅烧,得到氧化镁和氧化钙,再加入水发生消化反应,净化得到氢氧化镁,与二氧化碳发生碳化反应,Mg(OH)2+2CO2═Mg(HCO3)2,再热解得到产品,反应为:5Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$[4MgCO3•Mg(OH)2•4H2O+6CO2↑,
(1)选择转化率大但是又不多余耗能的;
(2)由流程图可知Mg(HCO3)2由Mg(OH)2和2CO2反应而来;
(3)流程图中煅烧反应和最后的热解反应能提高二氧化碳;
(4)①根据离子不沉淀,离子积小于溶度积计算;
②把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂应为不会生成污染环境的物质为佳;
③方案1中加入碳酸钠的产品中易混入更多杂质,不易提纯.
解答 解:(1)由图可知,70℃时,物质的转化率较大,但是温度进一步升高同等幅度,转化率几乎不变,但能耗增加;
故答案为:70℃;温度进一步升高同等幅度,转化率几乎不变,但能耗增加;
(2)由流程图可知Mg(HCO3)2由Mg(OH)2和2CO2反应而来,反应为:Mg(OH)2+2CO2═Mg(HCO3)2;
故答案为:Mg(OH)2+2CO2═Mg(HCO3)2;
(3)煅烧反应中碳酸镁和碳酸钙生成二氧化碳,热解反应生成二氧化碳;
故答案为:煅烧反应;热解反应;
(4)①已知:Ksp(Mn(OH)2)=10-14,常温时当调节溶液pH为9.5时,c(OH-)=10-4.5,此时Mn2+小于不沉淀,则c(Mn2+)•c(OH-)2<Ksp(Mn(OH)2)=10-14,则c(Mn2+)<$\frac{1{0}^{-14}}{(1{0}^{-4.5})^{2}}$=10-5;
故答案为:10-5;
②把Fe2+转化为Fe3+,从环境角度选择过氧化氢的产物为水,不污染环境;
故答案为:C;
③利用卤水碳化法制取轻质碳酸镁,方案1中加入碳酸钠的产品中易混入更多杂质,不易提纯,故方案2更合适;
故答案为:方案2;加入碳酸钠的产品中易混入更多杂质,不易提纯.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 第一步需选用仪器①、②和⑨,仪器①的名称叫坩埚 | |
| B. | 第二步用浓硝酸溶解茶叶灰,可能将Fe2+氧化成Fe3+ | |
| C. | 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 | |
| D. | 第四步,用试剂⑧检验滤液中的Fe3+,溶液中生成血红色沉淀 |
| A. | 2.2g | B. | 4.2g | C. | 4.4g | D. | 4.8g |
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 氨气的水溶液可以导电,但氨气属于非电解质 | |
| C. | 使用催化剂可以让不自发的化学反应自发进行 | |
| D. | 电解质溶液的导电过程属于物理变化 |
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |
| A. | 活字印刷的泥活字是硅酸盐材料制成的 | |
| B. | 制指南针的磁石主要成分是四氧化三铁 | |
| C. | 引爆黑火药后,硫磺燃烧生成三氧化硫 | |
| D. | 用树皮造纸过程主要是提取其中的纤维素 |
下列离子能大量共存,且满足相应要求的是
选项 | 离子 | 要求 |
A | K+、Cl-、SO42-、MnO4- | c(K+)< c(Cl-) |
B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
C[ | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH溶液立刻有气体产生 |
D | Na+、Mg2+、Ag+、NO3- | 滴加氨水先有沉淀产生,后沉淀部分溶解 |
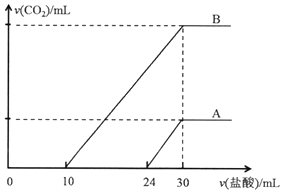 向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.