题目内容
6.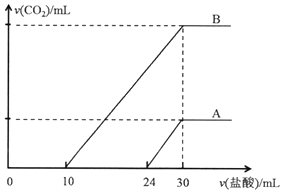 向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
向两份30ml同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25mol•L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.请回答下列问题:
(1)NaOH溶液的物质的量浓度为0.25mol•L-1.
(2)M、N两溶液中相同组分溶质的物质的量之比为3:5.
分析 (1)加入30ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液,根据氯离子、钠离子守恒,计算出氢氧化钠的物质的量,再根据物质的量浓度的定义计算;
(2)碳酸钠溶液中加入逐滴滴入盐酸,依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,结合图象分析各段发生反应,据此判断溶质的成分及物质的量.
解答 解:(1)加入30ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,
所以n(NaOH)=n(NaCl)=n(HCl)=0.030L×0.25mol/L=0.0075mol,则氢氧化钠溶液物质的量浓度C=$\frac{0.0075mol}{0.030L}$=0.25mol/L;
故答案为:0.25mol/L;
(2)碳酸钠溶液中加入逐滴滴入盐酸,依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,
依据情况A可知,24-30段为碳酸氢钠与盐酸反应,则溶液中碳酸钠消耗的盐酸体积为30-24=6ml,说明溶质为碳酸钠与氢氧化钠混合物,依据方程式:Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.006L×0.25mol•L-1=0.0015mol;
依据情况B知,10-30段为碳酸氢钠与盐酸反应,若溶质为碳酸钠则溶液中碳酸钠消耗的盐酸体积为30-10=20mL,而B中0-10mL<20mL,说明B中溶质为碳酸钠和碳酸氢钠,前10mL盐酸为碳酸钠与盐酸反应生成碳酸氢钠,依据Na2CO3+HCl=NaHCO3+NaCl,碳酸钠的物质的量为:0.010L×0.25mol•L-1=0.0025mol;
所以M、N两溶液中相同组分溶质的物质的量之比为:0.0015mol;0.0025mol=3:5;
故答案为:3:5.
点评 本题考查了物质的量浓度有关计算,明确图象含义及各段发生反应实质是解题关键,题目难度中等.

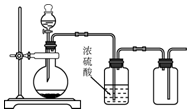
| A. | 用锌和稀硫酸制备H2 | B. | 用铜和稀硝酸制备NO | ||
| C. | 用30%H2O2水溶液和MnO2制备O2 | D. | 用MnO2和浓盐酸制备Cl2 |
| A. | 一定为1:1 | B. | 可能为2:3 | C. | 一定为3:2 | D. | 可能为1:6 |
| A. | 两个隔离的不同半电池通过盐桥连接可以组成原电池 | |
| B. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| C. | 在铁上镀银,用银作阳极 | |
| D. | 牺牲阳极的阴极保护法利用的是原电池原理 |
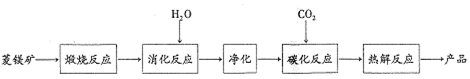
(1)根据下列表格数据,选择消化反应的最佳温度70℃;理由是温度进一步升高同等幅度,转化率几乎不变,但能耗增加.
| 消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(3)流程图中煅烧反应和热解反应可以为碳化反应提供二氧化碳源.
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5时,可以认为完全除去.常温时当调节溶液pH为9.5时,此时Mn2+小于10-5mol/L,不会沉淀出来.
| 物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
A.Ca(C1O)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为方案2,理由是加入碳酸钠的产品中易混入更多杂质,不易提纯.

| 选项 | 实验 | 现象 | 结论或解释 |
| A | 纯净的H2在Cl2中燃烧 | 安静地燃烧,并发出苍白色火焰 | 说明燃烧不一定需要氧气参加 |
| B | 分别将蘸有浓氨水和浓硫酸的玻璃棒靠近 | 产生白烟 | NH3能和酸反应生成了相应的铵盐 |
| C | 把SO2通入高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 说明SO2只具有漂白性 |
| D | 高温下,SiO2与纯碱混合加热,产生气体通入澄清石灰水 | 石灰水变浑浊 | 说明硅酸的酸性比碳酸强 |
| A. | A | B. | B | C. | C | D. | D |
