题目内容
9.麦秸杆、木屑等废料经干馏制燃料气过程中产生大量的废液,俗称木醋液(主要成分乙酸,还含少量的甲醇、苯酚、焦油等).以木醋液与白云石(主要成分2MgCO3•3CaCO3,还含有SiO2等杂质)等为原料,可制备出绿色环保型融雪剂CMA(醋酸钙、醋酸镁固体的混合物).CMA生产流程如图1:
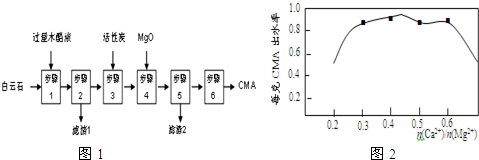
(1)步骤①发生反应的离子方程式为MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O.
(2)滤渣1的主要成分为SiO2(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色焦油外,产生颜色的另一主要原因是实验过程中苯酚被空气中氧气氧化最终产生褐色物质.
(3)步骤③是往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有吸附性.实验测知CMA中钙、镁离子的物质的量之比与出水率(与融雪效果成正比)的关系如图.
(4)由图2知,当CMA中n(Ca2+):n(Mg2+)约为b 时融雪的效果最好.(选填字母)
a.1:2 b.3:7 c.2:3
步骤④的目的主要是调节钙、镁离子的物质的量之比,除去过量的乙酸.
(5)步骤⑥包含的操作有蒸发结晶、过滤、洗涤及干燥.
分析 根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,除去被氧化的苯酚、焦油等杂质,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,据此答题;
解答 解:根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,除去被氧化的苯酚、焦油等杂质,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,
(1)根据上面的分析可知,步骤①发生的反应离子方程式为 MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O,
故答案为:MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O;
(2)步骤②所得滤渣1的主要成分为二氧化硅,化学式为SiO2,步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是实验过程中苯酚被空气中氧气氧化最终产生褐色物质,
故答案为:SiO2;实验过程中苯酚被空气中氧气氧化最终产生褐色物质;
(3)往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有吸附性,根据如图2所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系,可知,当n(Ca):n(Mg)约为3:7时,出水率最高,所以步骤④的目的除调节n(Ca):n(Mg)约为3:7,故选b,步骤④中加入氧化镁的目的是调节钙、镁离子的物质的量之比,除去过量的乙酸,
故答案为:吸附性;b;调节钙、镁离子的物质的量之比,除去过量的乙酸;
(4)根据上面的分析可知,步骤⑥包含的操作有 蒸发结晶、过滤、洗涤及干燥,
故答案为:蒸发结晶.
点评 本题考查学生阅读题目获取信息能力、对工艺流程的理解、物质推断、物质分离提纯与条件控制等,综合性较强,题目难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | Li为电池的负极 | |
| B. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| C. | 电池的电解液可用LiCl水溶液代替 | |
| D. | 放电时电子从负极经外电路流向正极 |
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为60% | |
| B. | 在25℃时,反应可表示为X+3Y═2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 升高温度此反应的平衡常数增大 |
| A. | 一定有新的物质生成 | |
| B. | 必然发生旧化学键断裂,新化学键形成 | |
| C. | 原子的数目可能有变化 | |
| D. | 必然伴随着能量的变化 |
| A. | 经测定某物质只含一种元素,则该物质一定是单质 | |
| B. | 阳离子、阴离子中均分别只含一种元素,则由这样的阴、阳离子组成的物质一定为纯净物 | |
| C. | 既能和酸反应又能和碱反应的化合物一定为两性化合物 | |
| D. | 酸性氧化物均可与强碱反应,碱性氧化物都是金属氧化物 |

 ,B在元素周期表的位置第二周期IVA族;
,B在元素周期表的位置第二周期IVA族; ;
;