题目内容
实验室也常用高锰酸钾(KMnO4)与浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)此反的还原剂是: ,反应电子转移的数目为:
(2)反应中如果消耗31.6g KMnO4,则反应放出的氯气在标准状况下为 L
(3)如果用二氧化锰与浓盐酸制取等量的氯气,则消耗盐酸多少g?
(1)此反的还原剂是:
(2)反应中如果消耗31.6g KMnO4,则反应放出的氯气在标准状况下为
(3)如果用二氧化锰与浓盐酸制取等量的氯气,则消耗盐酸多少g?
考点:氧化还原反应的计算,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:(1)所含元素化合价升高的反应物是还原剂;反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,据此计算反应电子转移的数目;
(2)根据反应方程式计算生成氯气的物质的量;
(3)反应方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,根据方程式计算消耗盐酸.
(2)根据反应方程式计算生成氯气的物质的量;
(3)反应方程式为MnO2+4HCl(浓)
| ||
解答:
解:(1)反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中只有氯元素的化合价升高,由HCl中的-1升高为氯气中的0价,所以HCl是还原剂,
反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,有2molKMnO4参加反应,所以转移的电子数目为2mol×(7-2)=10mol,
故答案为:HCl;10e-.
(2)31.6g KMnO4的物质的量为
=0.2mol,由反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O可知,生成的氯气的物质的量为0.2mol×
=0.5mol,所以标准状况下,氯气的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2;
(3)生成氯气0.5mol,由反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O可知,参加反应的HCl的物质的量为0.5mol×4=2mol,所以消耗HCl的质量为2mol×36.5g/mol=73g,
答:消耗HCl的质量为73g.
反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,有2molKMnO4参加反应,所以转移的电子数目为2mol×(7-2)=10mol,
故答案为:HCl;10e-.
(2)31.6g KMnO4的物质的量为
| 31.6g |
| 158g/mol |
| 5 |
| 2 |
(3)生成氯气0.5mol,由反应MnO2+4HCl(浓)
| ||
答:消耗HCl的质量为73g.
点评:本题考查氧化还原反应基本概念与计算,难度不大,(2)(3)都可以利用电子转移守恒计算,但不如根据方程式直观简单.根据情况选择.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
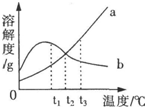 有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )
有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )| A、a物质的溶解度随着温度的升高而增大 |
| B、在t2℃时,a、b两种物质的溶液中溶质的质量分数一定相等 |
| C、t3℃时,a物质的溶解度大于b物质的溶解度 |
| D、将a、b两种物质的饱和溶液从t3℃降温至t1℃,a有晶体析出,b无晶体析出 |
恒温、恒压下,1molA和nmolB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g). 一段时间后达到平衡,生成amolC.则下列说法中正确的是( )
| A、若起始时放入3molA和3nmolB,则达平衡时生成3amolC | ||
B、起始时刻和达平衡后容器中的压强比为(1+n):(1+n-
| ||
| C、物质A、B的转化率之比为1:2 | ||
| D、当v正(A)═2v逆(C)时,可断定反应应达平衡 |
某固体仅有一种元素组成,其密度为5g/cm3,用X射线研究该固体的结果表明,在边长为1nm(1nm=10-9m)的立方体中仅有20个原子,则此元素的相对原子质量接近( )
| A、32 | B、65 |
| C、120 | D、150 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、6.5g金属锌变成锌离子时失去的电子数目为0.1NA |
| B、常温常压下,2g氢气所含原子数目为2NA |
| C、标准状况下,11.2LH2O含有的分子数为0.5NA |
| D、常温常压下,11.2LCl2含有的分子数为0.5NA |
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1molCH5+离子(碳正离子)所含电子数为10NA |
| B、含0.5molNa2SO4的溶液中含有NA个Na+ |
| C、1molNa2O2固体中含有2NA个O- |
| D、3.2克CH4气体完全燃烧需O2的分子数为0.2NA |