题目内容
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
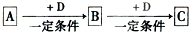
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体.则A转化为B反应的化学方程式为 .
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则C中阴阳离子个数比为 .
(3)若D是常见过渡金属,欲将反应B+D→C设计成原电池,正极材料可以采用 ,正极的电极反应式为 .
(4)若D是一种常见的温室气体:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子.则B转化为C的离子方程式为 .
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 .
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为 .
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,任写一个工业上采用氨水吸收B时,水溶液中发生的氧化还原反应的方程式 .
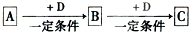
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体.则A转化为B反应的化学方程式为
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则C中阴阳离子个数比为
(3)若D是常见过渡金属,欲将反应B+D→C设计成原电池,正极材料可以采用
(4)若D是一种常见的温室气体:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子.则B转化为C的离子方程式为
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,任写一个工业上采用氨水吸收B时,水溶液中发生的氧化还原反应的方程式
考点:无机物的推断,原电池和电解池的工作原理
专题:推断题,电化学专题,元素及其化合物
分析:(1)依据物质特征反应现象和物质性质分析,A为氨气,C为NO2;
(2)D是具有氧化性的单质,A属于短周期主族金属单质判断金属为Na;
(3)D是常见过渡金属,推断为Fe,欲将反应B+D→C设计成原电池,说明是铁和氯化铁的反应;
(4)D是一种常见的温室气体为CO2:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,结合与二氧化碳反应判断为NaOH;
(5)D为氯碱工业的主要产品,为NaOH,B具有两性推断为Al(OH)3;
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,推断为D为C,B为CO2,C为CO;
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,可以判断为A为H2S,B为SO2,C为H2SO4.
(2)D是具有氧化性的单质,A属于短周期主族金属单质判断金属为Na;
(3)D是常见过渡金属,推断为Fe,欲将反应B+D→C设计成原电池,说明是铁和氯化铁的反应;
(4)D是一种常见的温室气体为CO2:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,结合与二氧化碳反应判断为NaOH;
(5)D为氯碱工业的主要产品,为NaOH,B具有两性推断为Al(OH)3;
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,推断为D为C,B为CO2,C为CO;
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,可以判断为A为H2S,B为SO2,C为H2SO4.
解答:
解:(1)若A能使湿润的红色石蕊试纸变蓝证明是;C为红棕色气体.则A转化为B反应的化学方程式为4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(2)若D是具有氧化性的单质判断为O2,A属于短周期主族金属单质,判断为Na,则C为Na2O2,过氧化钠中阴离子为过氧根离子,阳离子为钠离子,阴阳离子个数比为1:2,
故答案为:1:2;
(3)D是常见过渡金属,推断为Fe,欲将反应B+D→C设计成原电池,说明是铁和氯化铁的反应;正极上得到电子发生还原反应,正极材料可以采用石墨等惰性电极,电极反应式为三价铁离子得到电子被还原为二价铁离子,离子方程式为Fe3++e-=Fe2+,故答案为:Fe3++e-=Fe2+;
(4)D是一种常见的温室气体为CO2,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,结合与二氧化碳反应判断为NaOH,B(Na2CO3)转化为C(HCO3-)的离子方程式为:CO32-+CO2+H2O=2HCO3-,故答案为:CO32-+CO2+H2O=2HCO3-;
(5)D为氯碱工业的主要产品,为NaOH,B具有两性推断为Al(OH)3;则C溶液是氢氧化铝和氢氧化钠反应生成偏铝酸钠,溶液中除氢氧根外还存在的阴离子的化学式为:AlO2-,
故答案为:AlO2-;
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,推断为D为C,B为CO2,C为CO,B分子的结构式为:O=C=O,故答案为:O=C=O;
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,可以判断为A为H2S,B为SO2,C为H2SO4;工业上采用氨水吸收B时,的反应为:NH3?H2O+SO2=NH4HSO3;水溶液中发生的氧化还原反应的方程式:2NH4HSO3+O2=2NH4HSO4,故答案为:2NH4HSO3+O2=2NH4HSO4.
| ||
| △ |
| ||
| △ |
(2)若D是具有氧化性的单质判断为O2,A属于短周期主族金属单质,判断为Na,则C为Na2O2,过氧化钠中阴离子为过氧根离子,阳离子为钠离子,阴阳离子个数比为1:2,
故答案为:1:2;
(3)D是常见过渡金属,推断为Fe,欲将反应B+D→C设计成原电池,说明是铁和氯化铁的反应;正极上得到电子发生还原反应,正极材料可以采用石墨等惰性电极,电极反应式为三价铁离子得到电子被还原为二价铁离子,离子方程式为Fe3++e-=Fe2+,故答案为:Fe3++e-=Fe2+;
(4)D是一种常见的温室气体为CO2,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,结合与二氧化碳反应判断为NaOH,B(Na2CO3)转化为C(HCO3-)的离子方程式为:CO32-+CO2+H2O=2HCO3-,故答案为:CO32-+CO2+H2O=2HCO3-;
(5)D为氯碱工业的主要产品,为NaOH,B具有两性推断为Al(OH)3;则C溶液是氢氧化铝和氢氧化钠反应生成偏铝酸钠,溶液中除氢氧根外还存在的阴离子的化学式为:AlO2-,
故答案为:AlO2-;
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,推断为D为C,B为CO2,C为CO,B分子的结构式为:O=C=O,故答案为:O=C=O;
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,可以判断为A为H2S,B为SO2,C为H2SO4;工业上采用氨水吸收B时,的反应为:NH3?H2O+SO2=NH4HSO3;水溶液中发生的氧化还原反应的方程式:2NH4HSO3+O2=2NH4HSO4,故答案为:2NH4HSO3+O2=2NH4HSO4.
点评:本题考查了物质推断的关系应用,物质性质的应用,主要考查了氮及其化合物、铁及其化合物、碳及其化合物、硫及其化合物的性质应用,特征性质和现象是解题关键.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、乙烯的最简式CH2 |
| B、乙醇的结构简式C2H6O |
C、四氯化碳的电子式 |
| D、烃的组成均符合通式CnH2n+2 |
分子与原子的根本区别是( )
| A、分子与原子都是构成物质的微粒 |
| B、分子大,原子小 |
| C、分子在化学反应中可以再分,而原子不能再分 |
| D、分子能保持物质的化学性质,而原子不能 |
能正确表示下列反应的离子方程式是( )
| A、将氯气溶于水制备次氯酸:Cl2+H2O?2H++Cl-+ClO- |
| B、碳酸氢铵与过量的NaOH溶液反应:NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O |
| C、NaOH溶液中通入少量二氧化硫:SO2+0Hˉ=HSO3- |
| D、稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
在装有空气的密闭容器中,欲用燃烧的方法除去其中的氧气,又不能混入其他气体,可以使用的可燃物是( )
| A、木炭 | B、红磷 | C、硫 | D、蜡烛 |
下列叙述不正确的是( )
| A、等温等压下,3mol C2H2(g) 和1molC6H6(g)的密度相等 |
| B、同质量、不同密度的N2和CO气体所含原子数一定相等 |
| C、温度和密度都相同,Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2) |
| D、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等 |
