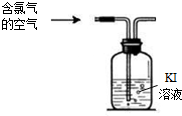
题目内容
6.下列反应的离子方程式正确的是( )| A. | Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | CaCO3与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | Cu与FeCl3溶液反应:Cu+Fe3+═Cu2++Fe2+ |
分析 A.漏写生成水的离子反应;
B.醋酸在离子反应中保留化学式;
C.反应生成碳酸钠和水;
D.电子、电荷不守恒.
解答 解:A.Ba(OH)2溶液与稀硫酸反应的离子反应为2OH-+2H++Ba2++SO42-═2H2O+BaSO4↓,故A错误;
B.CaCO3与醋酸反应的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故B错误;
C.NaHCO3溶液与NaOH溶液反应的离子反应为HCO3-+OH-═CO32-+H2O,故C正确;
D.Cu与FeCl3溶液反应的离子反应为Cu+2Fe3+═Cu2++2Fe2+,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
16.物质的量浓度相同的下列溶液中,按pH由小到大顺序排列的是( )
| A. | Na2CO3、NaHCO3、NaCl、HCl | B. | Na2CO3、NaHCO3、HCl、NaCl | ||
| C. | (NH4)2SO4、NH4Cl、NaNO3、Na2CO3 | D. | NH4Cl、(NH4)2SO4、Na2CO3、NaNO3 |
1.下列事实与胶体性质无关的是( )
| A. | 豆浆中加入CaSO4制豆腐 | |
| B. | 清晨在茂密的森林里看到缕缕阳光穿过林木枝叶 | |
| C. | FeCl3溶液中加入NaOH溶液产生红褐色沉淀 | |
| D. | 使用钢笔时不宜将不同品牌的墨水混用 |
15.氨是化肥工业和基本有机化工的主要原料,合成氨工业因此成为基本无机化工之一.回答下列问题:
(1)如何获得廉价的氢气是合成氨工业中的重要课题,目前常用戊烷跟水蒸气反应的方法 获得氢气:
C5H12(g)+5H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$5CO(g)+11H2(g)
已知几个反应的能量变化如图所示,则上述反应的△H=c-5a-11bkJ•mol-1
 (2)合成氨的反应原理为:
(2)合成氨的反应原理为:
3H2(g)+N2(g) $?_{催化剂}^{高温高压}$2NH3(g)
现有甲、乙、丙3个固定容积为2L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表所示:
①下列描述不能说明该反应已达到平衡状态的是a.(填序号);
a.容器内混合气体的密度保持不变
b.3v正(N2)═v逆(H2)
c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20min后达到平衡,这段时间内NH3的平均反应速率v(NH3)=0.05mol•L-1•min-1,该温度下,反应的平衡常数K=5.33L2•mol-2(结果保留3位有效数字);
③分析上表中的数据,下列关系正确的是ac(填序号).
a.cl>c3 b.wl<w2 c.ρ2>ρ1>ρ3
(3)在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是将产物混合气中的氨冷却分离后,剩余气体循环使用.
(1)如何获得廉价的氢气是合成氨工业中的重要课题,目前常用戊烷跟水蒸气反应的方法 获得氢气:
C5H12(g)+5H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$5CO(g)+11H2(g)
已知几个反应的能量变化如图所示,则上述反应的△H=c-5a-11bkJ•mol-1
 (2)合成氨的反应原理为:
(2)合成氨的反应原理为:3H2(g)+N2(g) $?_{催化剂}^{高温高压}$2NH3(g)
现有甲、乙、丙3个固定容积为2L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表所示:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol H2、2molN2 | 4mol H2、4molN2 | 2mol NH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| 平衡时N2的体积分数 | w1 | W2 | W3 |
| 混合气体的密度(g•L-1) | ρ1 | ρ2 | ρ3 |
a.容器内混合气体的密度保持不变
b.3v正(N2)═v逆(H2)
c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20min后达到平衡,这段时间内NH3的平均反应速率v(NH3)=0.05mol•L-1•min-1,该温度下,反应的平衡常数K=5.33L2•mol-2(结果保留3位有效数字);
③分析上表中的数据,下列关系正确的是ac(填序号).
a.cl>c3 b.wl<w2 c.ρ2>ρ1>ρ3
(3)在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是将产物混合气中的氨冷却分离后,剩余气体循环使用.

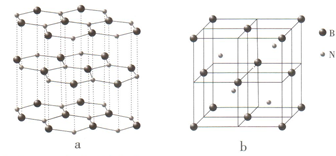 氮元素可形成丰富多彩的物质.
氮元素可形成丰富多彩的物质.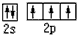 ;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1.
;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1. 氯气及其相关产品在生活、生产中应用广泛.
氯气及其相关产品在生活、生产中应用广泛.