题目内容
18.按要求填写下列相关内容:(1)在常温下,将体积为VaL、pH为a的稀硫酸和体积为VbL、pH为b的烧碱溶液混合,若所得混合液为中性.如果a+b=15,则Va:Vb=10:1.
某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb=1:10.
(2)中和相同体积,相同pH的Ba(OH)2、NH3•H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为V2>V3=V1(用“V1、V2、V3”和“>、<、=”表示).
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同pH的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是B>A=C.(填酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是A=B=C,反应所用时间长短关系是A=C>B.
分析 (1)在常温下,有体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=15,计算得到Va:Vb;
根据该温度下水的离子积计算出氢氧化钠的浓度、硫酸中氢离子浓度,然后根据反应后溶液显示中性计算出两溶液的体积之比;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,然后结合酸碱中和时c(OH-)越大,消耗酸越多;
(3)①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
②反应速率与氢离子浓度成正比;酸中氢离子浓度越大,反应速率越快,反应时间越短,反应过程中醋酸不断电离.
解答 解:(1)体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=15,计算得到Va:Vb =10-14+a+b=101=10:1;
若所得混合溶液为中性,pH=b的NaOH溶液中c(H+)=10-bmol/L,c(OH-)=$\frac{1×1{0}^{-13}}{1{0}^{-b}}$mol/L
pH=a的硫酸溶液中c(H+)=10-amol/L,因c(H+)×Va=c(OH-)×Vb,则10-a×Va=$\frac{1×1{0}^{-13}}{1{0}^{-b}}$mol/L×Vb,结合a+b=12整理可得:Va:Vb=1:10,
故答案为:10:1;1:10;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V3,
但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2>V3,
所以消耗酸的体积关系为:V2>V3=V1,
故答案为:V2>V3=V1;
(3)醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离,
①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是:B>A=C,
故答案为:B>A=C;
②反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,则反应时间大小为:A=C>B,
故答案为:A=B=C;A=C>B.
点评 本题考查了弱碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

| A. | 向某溶液中滴加KSCN 溶液,溶液呈血红色,证明存在Fe3+ | |
| B. | 氢氧化钠溶液保存在带橡皮塞的试剂瓶中 | |
| C. | 漂白粉常作环境消毒剂 | |
| D. | 工业上用电解饱和食盐水来制取金属钠 |
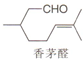
| A. | 分子式是C10H18O | B. | 至少有六个碳原子处于同一平面 | ||
| C. | 能与新制Cu(OH)2悬浊液反应 | D. | 能与H2或Br2发生加成反应 |
| A. | Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | CaCO3与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | Cu与FeCl3溶液反应:Cu+Fe3+═Cu2++Fe2+ |
| A. | 标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA | |
| B. | 1L0.1mol?L-1氨水中NH3?H2O分子数为0.1NA | |
| C. | 标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA | |
| D. | 10g46%酒精(C2H5OH)中含氧原子总数为0.1NA |
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在Kw/c(OH-)=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1 mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
| 选项 | |||
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状碳 | 浓硫酸具有脱水性和强氧化性 |
| B | 向盛有Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色退去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| C | 向盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸具有强氧化性和酸性 |
| D | 向浓度均为KCl、KI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
| A. | 澄清的石灰水 | B. | 饱和碳酸钠溶液 | C. | 氯化钙溶液 | D. | 硝酸钡溶液 |
| A. | v(A)=0.45mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.5mol/(L•min) | D. | v(D)=0.4mol/(L•s) |