题目内容
11.浓硫酸具有强氧化性可将红磷氧化为磷酸,其反应原理是2P+5H2SO4═2H3PO4+5SO2↑+2H2O若有1.24g的红磷参加反应,则:
(1)标出该反应的电子转移方向及数目.
(2)计算生成的SO2在标准状况下的体积.(写出计算过程)
分析 (1)先分析反应中元素化合价变化,然后判断转移的电子方向和数目,然后用双线桥或单线桥分析该氧化还原反应;
(2)根据n=$\frac{m}{M}$计算出1.24g红磷的物质的量,然后利用方程式计算出生成二氧化硫的体积.
解答 解:(1)2P+5H2SO4═2H3PO4+5SO2↑+2H2O反应中,浓硫酸中的+6价S原子得到电子被还原生成+4价的二氧化硫,红磷由0价被氧化生成+5价的磷酸,2个P原子总共失去10个电子,5个硫酸分子完全反应得到10个电子,则该反应的电子转移方向及数目为: ,
,
故答案为: ;
;
(2)1.24g红磷的物质的量为:$\frac{1.24g}{31g/mol}$=0.04mol,则:
2P+5H2SO4═2H3PO4+5SO2↑+2H2O
2mol 5×22.4 L
0.08mol V(SO2)
V(SO2)=$\frac{5×22.4L×0.04mol}{2}$=2.24 L
答:生成的SO2在标准状况下的体积为2.24L.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确氧化还原反应的实质与特征为解答关键,注意掌握用双线桥或单线桥分析氧化还原反应的方法,试题培养了学生的化学计算能力.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
1.下列关于${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$的说法正确的是( )
| A. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$不是同一种元素 | |
| B. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$互为同位素 | |
| C. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$都含有34个中子 |
2.在PH=1的溶液中,能大量共存的离子组是( )
| A. | Ca2+.Cl-.HCO3-.K+ | B. | Na+.Al3+.Cl-.SO42- | ||
| C. | NH4+.SO32-.Na+ NO3- | D. | Na+.SO42-.[Al(OH)4]-.OH- |
19.下列物质属于非电解质的是( )
| A. | 氯气 | B. | 醋酸 | C. | 氨气 | D. | 氯化钠溶液 |
6.下列反应的离子方程式正确的是( )
| A. | Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | CaCO3与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | Cu与FeCl3溶液反应:Cu+Fe3+═Cu2++Fe2+ |
16.下列离子方程式正确的是( )
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO |
3.室温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在Kw/c(OH-)=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1 mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
20.氨分解反应2NH3?N2+3H2在容积为2L的密闭容器内进行.已知起始时氨气的物质的量为4mol,5s时为2.4mol,则此时间段内用氮气的浓度变化表示该反应的平均速率为( )
| A. | 0.32mol/(L•s) | B. | 0.16mol/(L•s) | C. | 0.8mol/(L•s) | D. | 0.08mol/(L•s) |
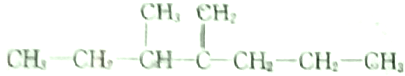 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯 ,可命名为1-甲基-3-乙基苯.
,可命名为1-甲基-3-乙基苯.