题目内容
7.amolFeS与bmolFeO投入VLcmol/L的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )| A. | 62(a+b)g | B. | 186(a+b)g | C. | (cV-$\frac{a+b}{3}$)mol | D. | (cV-$\frac{9a+b}{3}$)mol |
分析 分情况讨论:1、当硝酸恰好反应时,生成硝酸铁的硝酸就是未被还原的硝酸,根据铁离子的物质的量计算反应后溶液中NO3-的量;
2、当硝酸过量时,除去生成一氧化氮的硝酸就是未被还原的硝酸,根据氧化还原反应中得失电子守恒计算被还原的硝酸,硝酸总量-被还原的硝酸=反应后溶液中NO3-的量.
解答 解:当硝酸恰好反应时,生成硝酸铁的硝酸就是未被还原的硝酸,由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3中的NO3 -,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n〔Fe(NO3)3〕=n(Fe)=(a+b)mol,所以反应后溶液中NO3-的量为3(a+b)mol,反应后溶液中NO3-的质量=3(a+b)mol×63 g•mol-1=(a+b)×189 g;
当硝酸过量时,除去生成一氧化氮的硝酸就是未被还原的硝酸,反应中Fe元素由+2升高为+3,硫元素由-2升高为+6,氮元素由+5降低为+2,根据电子转移降守恒知:n(NO)=$\frac{amol×(1+8)+bmol×1}{5-2}$=$\frac{9a+b}{3}$mol,即显氧化性的硝酸的物质的量=$\frac{9a+b}{3}$mol,所以未被还原的硝酸为[cV-$\frac{9a+b}{3}$]mol,故D正确,
故选:D.
点评 本题考查氧化还原反应计算,题目难度中等,注意从化合价变化的角度分析,运用守恒法解答.

练习册系列答案
相关题目
18.甲醇是重要的化工原料和燃料.将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1是在两种投料比[$\frac{c(C{O}_{2})}{c({H}_{2}+CO)}$]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线,图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图
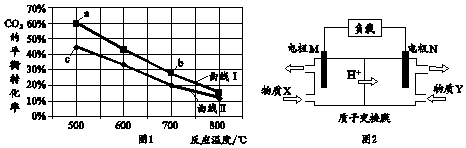
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 图1中b点对应的平衡常数K值大于c点 | |
| B. | 图1中a点对应的H2的转化率等于30% | |
| C. | 图2中电极M上发生还原反应 | |
| D. | 图2中电极N的反应式:H2O2+2e-+6H+=2H2O |
15.下列有关关仪器的使用方法或实验操作正确的是( )
| A. | 配制一定物质的量浓度溶液中,洗净的容量瓶要放进烘箱中烘干,以防溶液被稀释 | |
| B. | 测量Zn与稀硫酸反应速率的实验中,应在标准状况下测量H2的体积,以方便计算 | |
| C. | 酸碱滴定实验中,用待测溶液润洗锥形瓶,以减少实验误差 | |
| D. | 中和热的测定实验中,要用环形玻璃搅拌棒搅拌,使反应更充分 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.lmolC2H6O分子中含C-H键数目为0.5NA | |
| B. | 1L1mol•L-1的NH4Cl溶液中含有NH4+数目为0.1NA | |
| C. | 8.4gNaHCO3和MgCO3混合物中含有阴离子数目为0.1NA | |
| D. | 标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2NA |
12.分子式为C5H8O2的有机物,能水解且能发生银镜反应,则符合上述条件同分异构体(不考虑立体异构)有( )
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
19.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| B. | 利用CO2合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 我国汽油标准由“国III”提高到“国1V”,目的是减少有害气体的排放,改善环境质量 |
16.下列说法正确的是( )
| A. | 1molN2中含有的分子数为2×6.02×1023 | |
| B. | 用激光笔照射CuSO4溶液可产生“丁达尔效应” | |
| C. | 常温下,铝片能溶于浓硫酸 | |
| D. | 常温下,淀粉溶液遇I2变为蓝色 |
18.下列对有机物结构或性质的描述中,错误的是( )
| A. | 乙醇通过消去反应可制得乙烯 | |
| B. | CH3CH=CHCH3分子中的4个碳原子在同一平面上 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 在溴水中加入苯,振荡后溴水的颜色变浅,这是由于发生了加成反应 |