题目内容
3.在1L氯化钠溶液中,含有NaCl 5.85g,该溶液的物质的量浓度是0.1mol/L,量取该溶液10mL,它的物质的量浓度是0.1mol/L;将取出的溶液稀释至20mL,其物质的量浓度是0.05mol/L,其中含溶质0.0585g.分析 依据n=$\frac{m}{M}$计算氯化钠的物质的量,依据C=$\frac{n}{V}$计算物质的量浓度;依据溶液稀释过程中溶质物质的量不变计算稀释后溶液的物质的量浓度,依据m=CVM 计算溶质的质量.
解答 解:在1L氯化钠溶液中,含有NaCl 5.85g,溶质的物质的量为:$\frac{5.85g}{58.5g/mol}$=0.1mol,物质的量浓度为:$\frac{0.1mol}{1L}$=0.1mol/L;
溶液具有均一性,所以取10mL该溶液,溶液的浓度为0.1mol/L;
设稀释后溶液物质的量浓度为C′,则依据溶液稀释过程中溶质物质的量不变得:0.1mol/L×10mL=20mL×C′,解得C′=0.05mol/L;
含有溶质的质量为:0.1mol/L×0.01L×58.5g/mol=0.0585g;
故答案为:0.1mol/L;0.1mol/L;0.05mol/L;0.0585.
点评 本题考查了物质的量浓度有关计算,明确以物质的量为核心计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
13.下列有关化学实验安全问题的叙述正确的是( )
| A. | 制备H2时,为防止H2逸出,待刚刚出现气泡时就在气体发生器出气口点燃 | |
| B. | 取用化学药品时,应特别注意药品包装容器上的安全警示标志 | |
| C. | 凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂 | |
| D. | 为更清楚地闻到化学药品的气味可使鼻子凑近药品 |
14.青霉素在体内经酸性水解后得到一种有机物X. 己知X的结构如图,下列有关X的说法正确的是( )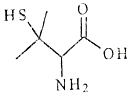

| A. | X的分子式为C5H10NO2S | |
| B. | X有2个手性碳原子 | |
| C. | X能发生加聚反应生成高分子化合物 | |
| D. | X既能与强酸反应,又能与强碱反应 |
11.下列有机物中,互为同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 淀粉和纤维素 | ||
| C. | 硬脂酸和软脂酸 | D. | 甘氨酸和硝基乙烷 |
6.室温下,将1.000mol•L-1盐酸逐滴滴入20.00mL 1.000mol•L-1氨水中.溶液的pH和温度随加入盐酸的体积变化曲线如图所示.下列说法不正确的是( )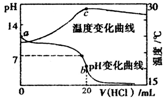

| A. | a点由水电离出的c(H+)<1.0×10-14mol•L-1 | |
| B. | b点时存在c(NH4+)+c(NH3•H2O)=c(C1-) | |
| C. | c点以后溶液温度下降的原因是盐酸的持续加入 | |
| D. | 在整个过程中可能会出现的离子浓度关系:c(NH4+)=c(C1-)>c(H+)=c(OH-) |
7.amolFeS与bmolFeO投入VLcmol/L的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
| A. | 62(a+b)g | B. | 186(a+b)g | C. | (cV-$\frac{a+b}{3}$)mol | D. | (cV-$\frac{9a+b}{3}$)mol |
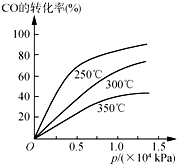 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇: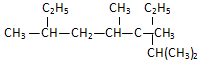 名称2,3,4,6-四甲基-3-乙基辛烷.
名称2,3,4,6-四甲基-3-乙基辛烷.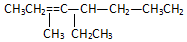 名称:2-甲基-3-乙基-1-戊烯.
名称:2-甲基-3-乙基-1-戊烯.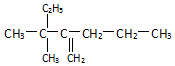 名称:3,3-二甲基-2-丙基-1-戊烯.
名称:3,3-二甲基-2-丙基-1-戊烯.