题目内容
下列化学反应的离子方程式正确的是( )
(1)向CH2ClCOOH中加入足量的氢氧化钠溶液并加热:CH2ClCOOH+OH-
CH2ClCOO-+H2O
(2)在稀氨水中通入过量CO2:NH3?H2O+CO2═NH4++HCO3-
(3)少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
(4)氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
(5)向小苏打溶液中加入过量的澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O
(6)向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
(7)向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH3-+OH-═NH3?H2O
(8)用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑
(1)向CH2ClCOOH中加入足量的氢氧化钠溶液并加热:CH2ClCOOH+OH-
| △ |
(2)在稀氨水中通入过量CO2:NH3?H2O+CO2═NH4++HCO3-
(3)少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
(4)氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
(5)向小苏打溶液中加入过量的澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O
(6)向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
(7)向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH3-+OH-═NH3?H2O
(8)用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑
| A、(2)(3)(5) |
| B、(3)(4)(6) |
| C、(1)(3)(5)(7)(8) |
| D、(2)(5)(6) |
考点:离子方程式的书写
专题:离子反应专题
分析:(1)向CH2ClCOOH中加入足量的氢氧化钠溶液并加热,-Cl发生水解,-COOH发生中和反应;
(2)在稀氨水中通入过量CO2,反应生成碳酸氢铵;
(3)少量SO2通入Ca(ClO)2溶液中,发生氧化还原反应生成硫酸钙;
(4)氢氧化铁溶于氢碘酸中,发生氧化还原反应生成碘化亚铁、碘、水;
(5)向小苏打溶液中加入过量的澄清石灰水,小苏打完全反应,生成碳酸钙、NaOH、水;
(6)向FeCl3溶液中加入Mg(OH)2,发生沉淀的转化;
(7)向磷酸二氢铵溶液中加入足量的氢氧化钠溶液,磷酸二氢根离子、铵根离子均反应;
(8)用稀HNO3溶解FeS固体,发生氧化还原反应生成硝酸铁、S、NO和水.
(2)在稀氨水中通入过量CO2,反应生成碳酸氢铵;
(3)少量SO2通入Ca(ClO)2溶液中,发生氧化还原反应生成硫酸钙;
(4)氢氧化铁溶于氢碘酸中,发生氧化还原反应生成碘化亚铁、碘、水;
(5)向小苏打溶液中加入过量的澄清石灰水,小苏打完全反应,生成碳酸钙、NaOH、水;
(6)向FeCl3溶液中加入Mg(OH)2,发生沉淀的转化;
(7)向磷酸二氢铵溶液中加入足量的氢氧化钠溶液,磷酸二氢根离子、铵根离子均反应;
(8)用稀HNO3溶解FeS固体,发生氧化还原反应生成硝酸铁、S、NO和水.
解答:
解:(1)向CH2ClCOOH中加入足量的氢氧化钠溶液并加热,离子反应为CH2ClCOOH+2OH-
CH2OHCOO-+H2O+Cl-,故错误;
(2)在稀氨水中通入过量CO2的离子反应为NH3?H2O+CO2═NH4++HCO3-,故正确;
(3)少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故错误;
(4)氢氧化铁溶于氢碘酸中的离子反应为2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故错误;
(5)向小苏打溶液中加入过量的澄清石灰水的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故正确;
(6)向FeCl3溶液中加入Mg(OH)2的离子反应为3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+,故正确;
(7)向磷酸二氢铵溶液中加入足量的氢氧化钠溶液的离子反应为H2PO4-+NH4++3OH-═NH3?H2O+2H2O+PO43-,故错误;
(8)用稀HNO3溶解FeS固体的离子反应为NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故错误;
故选D.
| △ |
(2)在稀氨水中通入过量CO2的离子反应为NH3?H2O+CO2═NH4++HCO3-,故正确;
(3)少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故错误;
(4)氢氧化铁溶于氢碘酸中的离子反应为2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故错误;
(5)向小苏打溶液中加入过量的澄清石灰水的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故正确;
(6)向FeCl3溶液中加入Mg(OH)2的离子反应为3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+,故正确;
(7)向磷酸二氢铵溶液中加入足量的氢氧化钠溶液的离子反应为H2PO4-+NH4++3OH-═NH3?H2O+2H2O+PO43-,故错误;
(8)用稀HNO3溶解FeS固体的离子反应为NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故错误;
故选D.
点评:本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
下列说法错误的是( )
| A、自然界中存在碳元素的单质,也存在硅元素的单质 |
| B、燃烧煤时加入适量的石灰石,可减少废气中二氧化硫的量 |
| C、利用丁达尔现象可以区分FeCl3溶液与Fe(OH)3胶体 |
| D、用焦炭在电炉中还原二氧化硅可得到含有少量杂质的粗硅 |
配制0.5mol/L的NaOH溶液1L,因操作不当使溶液浓度偏低的是( )
| A、用托盘天平称量20gNaOH时,使用生锈的砝码 |
| B、容量瓶中有少量的水 |
| C、定容时仰视容量瓶刻度线 |
| D、NaOH溶解后立即注入容量瓶中,洗涤、移液,并加蒸馏水定容至刻度线 |
有A、B、C、D四种金属.将A与B用导线连接起来,浸入电解质溶液中,B为正极.将A、D分别投入等浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化.如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A、D A B C |
| B、D C A B |
| C、B A D C |
| D、A B C D |
在指定条件下,下列各组离子一定能够大量共存的是( )
| A、能使甲基橙变黄的溶液中:Al3+、Na+、SO42-、CO32- | ||
| B、能与铝反应产生氢气的溶液:Na+、Fe2+、Cl-、NO3- | ||
C、
| ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
下列有关化学用语正确的是( )
| A、乙醇的结构简式:C2H6O |
| B、Cl-的电子排布式:1s22s22p63s23p6 |
C、硫离子的结构示意图: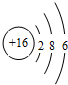 |
| D、氯化钠的分子式:NaCl |
下列叙述中,不正确的是( )
| A、Cl2和SO2分别通入品红试液中,均使品红试液褪色 |
| B、硝酸银溶液通常保存在棕色试剂瓶中 |
| C、常温下,铁和铝与浓硫酸不发生任何反应 |
| D、葡萄糖与新制的Cu(OH)2悬浊液反应,有砖红色物质生成 |
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A、NaCl溶液、BaS04 |
| B、铜、二氧化硫 |
| C、NaCl晶体、酒精 |
| D、熔融的KNO3、硫酸溶液 |