题目内容
甲、乙、丙、丁四位同学各取了0.1mol?L-1的一元酸(他们所取的酸可能是不同的)20.00mL,分别向其中滴加0.1mol?L-1的一元碱(他们所用的碱也可能是不同的),在滴加过程中不断测定混合液的pH,下表是测得的部分数据.
请回答下列问题:
(1)向酸溶液中滴加碱溶液时,盛装碱溶液所用的仪器是 .
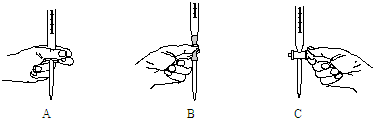
(2)滴定操作图示正确的是 (填编号).
(3)四位同学所选用的酸溶液pH最大的是 (在甲、乙、丙、丁中选填).
(4)请计算甲同学在滴入19.98mL碱溶液时,溶液的pH约为 (保留一位小数,可用对数形式表示).
(5)若以上酸碱用于中和滴定,试给出选用指示剂的建议(填在表格中)
| 测定溶液的pH | ||||
| 加入碱溶液的体积/mL | 甲 | 乙 | 丙 | 丁 |
| 19.98 | 4.3 | 7.7 | 4.3 | |
| 20.00 | 7.0 | 7.0 | 8.7 | 5.3 |
| 20.02 | 9.7 | 10.0 |
(1)向酸溶液中滴加碱溶液时,盛装碱溶液所用的仪器是
(2)滴定操作图示正确的是

(3)四位同学所选用的酸溶液pH最大的是
(4)请计算甲同学在滴入19.98mL碱溶液时,溶液的pH约为
(5)若以上酸碱用于中和滴定,试给出选用指示剂的建议(填在表格中)
| 甲 | 丙 | |
| 建议选用的指示剂 | | |
考点:中和滴定
专题:实验题
分析:(1)滴定时,碱溶液存放在碱式滴定管中;
(2)碱式滴定管放液体的方法:用食指和中指紧压橡皮管中的玻璃球,使液体流下;
(3)根据酸碱恰好反应只生成盐和水,根据盐溶液的酸碱性确定酸、碱的强弱和对应酸的强弱;
(4)在滴入19.98mL碱溶液时,酸过量,过量的酸为0.1mol?L-1×2×10-5L,计算过量的c(H+),进而根据pH=-lgc(H+)计算溶液的pH.
(5)根据酸碱恰好反应只生成盐和水,根据盐溶液的酸碱性结合指示剂的变色范围确定.
(2)碱式滴定管放液体的方法:用食指和中指紧压橡皮管中的玻璃球,使液体流下;
(3)根据酸碱恰好反应只生成盐和水,根据盐溶液的酸碱性确定酸、碱的强弱和对应酸的强弱;
(4)在滴入19.98mL碱溶液时,酸过量,过量的酸为0.1mol?L-1×2×10-5L,计算过量的c(H+),进而根据pH=-lgc(H+)计算溶液的pH.
(5)根据酸碱恰好反应只生成盐和水,根据盐溶液的酸碱性结合指示剂的变色范围确定.
解答:
解:(1)滴定时,向酸溶液中滴加碱溶液时,盛装碱溶液所用的仪器为碱式滴定管;
故答案为:碱式滴定管;
(2)碱溶液存放在碱式滴定管中,而A、C是酸式滴定管,碱式滴定管操作为:用食指和中指紧压橡皮管中的玻璃球,使液体流下;
故选:B;
(3)当加入20.00mL碱溶液时生成盐和水,甲、乙、丙、丁中只有丙溶液呈碱性,说明为强碱弱酸盐,所以所选用的酸溶液pH最大的是丙;
故答案为:丙;
(4)在滴入19.98mL碱溶液时,酸过量,过量的酸为0.1mol?L-1×2×10-5L,过量的c(H+)=
=5×10-5mol?L-1,pH=-lgc(H+)=5-lg5=4.3;
故答案为:4.3;
(5)甲滴定后溶液呈中性,应选择酸性或碱性变色范围的指示剂,如甲基橙或酚酞;丙滴定后溶液呈碱性,应选择碱性变色范围的指示剂,如酚酞;
故答案为:甲基橙或酚酞;酚酞.
故答案为:碱式滴定管;
(2)碱溶液存放在碱式滴定管中,而A、C是酸式滴定管,碱式滴定管操作为:用食指和中指紧压橡皮管中的玻璃球,使液体流下;
故选:B;
(3)当加入20.00mL碱溶液时生成盐和水,甲、乙、丙、丁中只有丙溶液呈碱性,说明为强碱弱酸盐,所以所选用的酸溶液pH最大的是丙;
故答案为:丙;
(4)在滴入19.98mL碱溶液时,酸过量,过量的酸为0.1mol?L-1×2×10-5L,过量的c(H+)=
| 0.1mol?L-1×2×10-5L |
| 0.04L |
故答案为:4.3;
(5)甲滴定后溶液呈中性,应选择酸性或碱性变色范围的指示剂,如甲基橙或酚酞;丙滴定后溶液呈碱性,应选择碱性变色范围的指示剂,如酚酞;
故答案为:甲基橙或酚酞;酚酞.
点评:本题主要考查酸碱中和滴定仪器的使用、盐类的水解、混合后溶液PH的计算以及指示剂的选择,题目难度不大,注意把握盐类的水解的运用.

练习册系列答案
相关题目
用NA表示阿伏伽德罗常数的数值.下列说法正确的是( )
| A、1L 1mol?L-1的NH4NO3溶液中氮原子数小于2NA |
| B、常温常压下,11.2g乙烯中含有共用电子对数目为2.4NA |
| C、在O2参加的反应中,1molO2作氧化剂时得到的电子数一定是4NA |
| D、标准状况下,22.4LCCl4中所含有的分子数为NA |
某元素在化学反应中由化合态变为游离态,则该元素( )
| A、一定被氧化 |
| B、一定被还原 |
| C、既可能被氧化,也可能被还原 |
| D、以上都不是 |
下列说法正确的是( )
| A、相对分子质量相同的物质是同种物质 |
| B、赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果 |
| C、具有同一通式的物质属于同系物 |
| D、含氮、磷的大量污水直接排入大海,是赤潮发生的直接原因 |
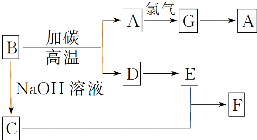 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.