题目内容
14.配平下列氧化还原反应方程式并用双线桥法表示其电子转移的方向和数目11P4+60CuSO4+96H2O--20Cu3P+60H2SO4+24H3PO4
反应中若有1mol H3PO4生成,则消耗的氧化剂及其物质的量分别为消耗的氧化剂硫酸铜物质的量为2.5mol,消耗氧化剂P4的物质的量为$\frac{5}{24}$mol.
分析 分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平,依据氧化还原反应方程式计算氧化剂的物质的量.
解答 解:该氧化还原反应中Cu元素的化合价由+2价降低到+1价,硫酸铜是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,
要使得失电子守恒H3PO4系数为24,Cu3P系数为20,依据原子个数守恒方程式为:
11P4+60CuSO4+96H2O=24H3PO4+20Cu3P+60H2SO4;
用双线桥表示为: ;
;
依据方程式可知:若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,
得到消耗氧化剂关系为:5P4+6P4+60CuSO4+96H2O=24H3PO4+20Cu3P+60H2SO4;
若有1mol H3PO4生成,则:
5P4+6P4+60CuSO4+96H2O=24H3PO4+20Cu3P+60H2SO4;
5 60 24
n n′1mol
解得n=$\frac{5}{24}$mol;n′=2.5mol;
所以若有1mol H3PO4生成,则消耗的氧化剂硫酸铜物质的量为2.5mol,消耗氧化剂P4的物质的量为$\frac{5}{24}$mol;
故答案为:11;60;96H2O;20;60;24; ;
;
消耗的氧化剂硫酸铜物质的量为2.5mol,消耗氧化剂P4的物质的量为$\frac{5}{24}$mol.
点评 本题考查了氧化还原方程式配平及氧化剂物质的量计算,明确氧化还原反应得失电子守恒、原子个数守恒是解题关键,题目难度中等.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
4.某二元酸(用H2B表示)在水中的电离方程式是H2B═H++HB-,HB-?H++B2-.在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是( )
| A. | c(H+)+c(HB-)+2c(H2B)=c(OH-) | B. | c(Na+)+c(OH-)=c(H+)+c(HB-) | ||
| C. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | D. | 2c(B2-)+2c(HB-)=0.2mol/L |
2.下列实验过程中出现异常情况,其可能原因分析错误的是( )
| 选项 | 异常情况 | 可能原因分析 |
| A | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 蒸馏:温度计读数达到了馏分的沸点且历时10分钟,锥形瓶中却无液体 | 温度计位置错误,或装置漏气,或冷凝水方向反了 |
| D | 检验Fe2+:加入KSCN溶液,溶液呈红色 | Fe2+已部分被氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
9.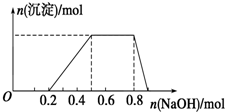 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )| A. | 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42- | |
| B. | 肯定不含的阳离子是Mg2+、Fe3+ | |
| C. | 要确定该溶液是否含有Na+,必须做焰色反应实验,看焰色是否为黄色 | |
| D. | 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42-)=2:3:1:4 |
19.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 1.5g甲基所含有的电子数是NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 17g羟基所含有的电子数是10NA | |
| D. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA |
3.把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b molNaOH刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol BaCl2,由此可知原溶液中NO3-的物质的量浓度是(单位:mol•L-1)( )
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-2c}{a}$ | D. | $\frac{2b-4c}{a}$ |
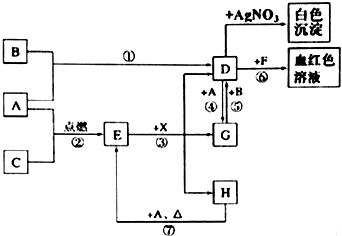
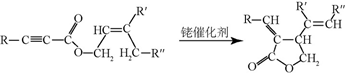
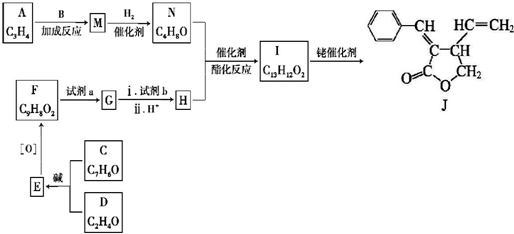
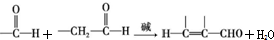
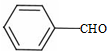 +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$ +H2O.
+H2O.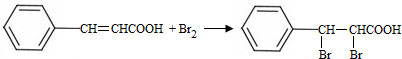 ;试剂b是NaOH、醇溶液.
;试剂b是NaOH、醇溶液.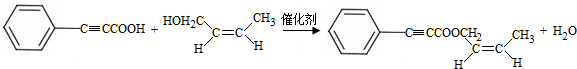 .
.