题目内容
2.下列实验过程中出现异常情况,其可能原因分析错误的是( )| 选项 | 异常情况 | 可能原因分析 |
| A | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 蒸馏:温度计读数达到了馏分的沸点且历时10分钟,锥形瓶中却无液体 | 温度计位置错误,或装置漏气,或冷凝水方向反了 |
| D | 检验Fe2+:加入KSCN溶液,溶液呈红色 | Fe2+已部分被氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.萃取剂与水互溶会造成液体静置不分层;
B.根据没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐即不与外界连通会使分液漏斗中的液体难以滴下;
C.温度计位置错误,或装置漏气,或冷凝水方向反了可能得不到液体;
D.向溶液中加入KSCN溶液,观察现象,若溶液变红色,说明溶液中存在Fe3+.
解答 解:A.因萃取剂与水互溶会造成液体静置不分层,与加入萃取剂的量较多无关,故A错误;
B.因没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐即不与外界连通会使分液漏斗中的液体难以滴下,故B正确;
C.温度计位置错误,温度过低,或装置漏气,或冷凝水方向反了可能得不到液体,故C正确;
D.如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色现象明显,这一反应是Fe3+的特征反应,所以用KSCN溶液,故D正确.
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的分离提纯以及离子的检验等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.

练习册系列答案
相关题目
12.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g),不能判断该分解反应已经达到化学平衡的是( )
| A. | v(NH3)正=2v(CO2)逆 | B. | 密闭容器中总压强不变 | ||
| C. | 密闭容器中氨气的体积分数不变 | D. | 密闭容器中混合气体的密度不变 |
13.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
10.下列反应中属于氧化还原反应,但是H2O既不是氧化剂,又不是还原剂的是( )
| A. | NaH+H2O═NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2F2+2H2O═4HF+O2 |
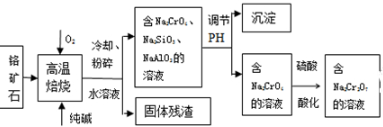
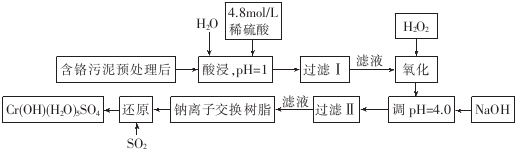
17.利用化学原理可以对工厂排放的废水、废渣等进行有效检测和处理.某工厂对制铬工业污泥中Cr(Ⅲ)的回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是升高温度,搅拌,过滤后再向滤渣中加入H2SO4 (多次浸取),适当延长浸取时间(至少一条).
(2)调pH=4.0是为了除去Fe3+
(3)钠离子交换树脂的作用原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Al3+、Mg2+
(4)试配平下列氧化还原反应方程式:2Fe2++1H2O2+2H+═2Fe3++2H2O( )
(5)通入SO2的目的是将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4.

常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
(2)调pH=4.0是为了除去Fe3+
(3)钠离子交换树脂的作用原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Al3+、Mg2+
(4)试配平下列氧化还原反应方程式:2Fe2++1H2O2+2H+═2Fe3++2H2O( )
(5)通入SO2的目的是将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4.
7.下列有关化学反应过程或实验现象的叙述中,正确的是( )
| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 氯水中加入红色鲜花,红花褪色,说明溶液中有Cl2存在 |
11.有人设想合成具有以下结构的烃分子,下列说法不正确的是( )


| A. | Ⅳ不可能合成得到 | B. | Ⅱ与苯互为同分异构体 | ||
| C. | Ⅲ(立方烷)的六氯代物共有3种 | D. | Ⅰ、Ⅱ、Ⅲ的实验式不同 |