题目内容
7.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 30 g C2H6中含有的化学键数目为8NA | |
| B. | 1 L0.1mol•L-1醋酸溶液中含有的H+数为0.1 NA | |
| C. | 78 g Na2O2;和Na2S的混合物中含有的阴离子数目为NA | |
| D. | 2.24 L CI2与足量铁粉在一定条件下充分反应,转移电子数为0.2 NA |
分析 A.1个乙烷分子中含有7个共价键;
B.醋酸为弱酸,部分电离;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.气体状况未知,无法计算氯气的物质的量.
解答 解:A.30 g C2H6物质的量为1mol,含有的化学键数目为7NA,故A错误;
B.醋酸为弱酸,部分电离,所以1 L0.1mol•L-1醋酸溶液中含有的H+数小于0.1 NA,故B错误;
C.78 g Na2O2和Na2S的混合物物质的量为1mol,过氧化钠中阳离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C正确;
D.体状况未知,无法计算氯气的物质的量,无法计算转移电子数目,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件是解题关键,注意乙烷分子结构,题目难度不大.

练习册系列答案
相关题目
17.选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 硝基苯(混合酸) | ||
| ③ | KNO3(NaCl) |
15.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应反应的化学方程式为C(s)+H2O(g) CO(g)+H2(g).
CO(g)+H2(g).
(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g)
该反应的平衡常数随温度的变化如表所示:
①该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})?c({H}_{2})}{c(CO)?c({H}_{2}O)}$.
②该反应的正反应方向是放热反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为75%.
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”).
(3)2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示:
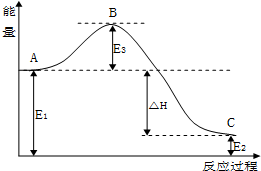
又已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1,请回答下列问题:
①图中E1、E2分别表示反应物总能、生成物总能量,E3的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”或“降低”)△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂可以降低反应的活化能,但不改变反应热.
②图中△H=-198kJ•mol-1.
(1)已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应反应的化学方程式为C(s)+H2O(g)
 CO(g)+H2(g).
CO(g)+H2(g).(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g)
该反应的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
②该反应的正反应方向是放热反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为75%.
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”).
(3)2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示:

又已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1,请回答下列问题:
①图中E1、E2分别表示反应物总能、生成物总能量,E3的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”或“降低”)△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂可以降低反应的活化能,但不改变反应热.
②图中△H=-198kJ•mol-1.
12.下列说法正确的是( )
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
16.下列说法正确的是( )
| A. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| B. | 所有化学变化的能量都可以通过原电池转化为电能 | |
| C. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| D. | 凡是需要加热的反应都是吸热反应 |
17.下列四组数字中,代表有机物的4种同系物的式量的( )
| A. | 16.32.48.64 | B. | 16.17.18.19 | C. | 16.30.44.58 | D. | 16.28.40.52 |




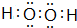 .
.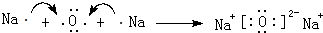 .
.