题目内容
18.在核磁共振氢谱中出现两组峰,其氢原子个数之比为3:2的化合物是( )| A. |  | B. |  | C. |  | D. |  |
分析 化合物的核磁共振氢谱中出现2组峰,说明有机物中含有2种类型的氢原子,氢原子数之比为3:2,分子中两种H原子数目相同,根据等效氢判断,分子中等效氢原子一般有如下情况:①、分子中同一甲基上连接的氢原子等效,②、同一碳原子所连甲基上的氢原子等效,③、处于镜面对称位置上的氢原子等效.
解答 解:A. 有两种氢原子,氢原子个数之比为3:1,故A错误;
有两种氢原子,氢原子个数之比为3:1,故A错误;
B. 有3种氢原子,氢原子个数之比为3:1:4,故B错误;
有3种氢原子,氢原子个数之比为3:1:4,故B错误;
C. 有两种氢原子,氢原子个数之比为3:2,故C正确;
有两种氢原子,氢原子个数之比为3:2,故C正确;
D. 有3种氢原子,氢原子个数之比为3:1:1,故D错误.
有3种氢原子,氢原子个数之比为3:1:1,故D错误.
故选C.
点评 本题考查对核磁共振氢谱的认识、有机物的结构等,难度不大,判断分子中等效氢是解题的关键,注意掌握等效氢的判断.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
8.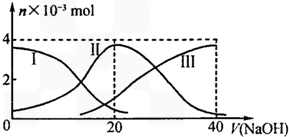 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| B. | 向Na2A溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |
9.如果1g水中含有n个氢原子,则阿伏加德罗常数是( )
| A. | $\frac{1}{n}$ mol-1 | B. | 9n mol-1 | C. | 2nmol-1 | D. | 18nmol-1 |
6.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 酸性溶液中:K+、MnO4+、SO42-Cl- | |
| B. | 能使甲基橙显红色的溶液:Fe2+,NO3-,Na+,SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=l0-12的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 酸性透明溶液中:Cu2+、Al3+、SO42-、NO3- |
3.电子层数相同的三种元素X、Y、Z它们的气态氢化物稳定性顺序为HX>H2Y>H3Z,下列判断错误的是( )
| A. | 离子半径X>Y>Z | |
| B. | 元素原子得电子能力X>Y>Z | |
| C. | 最高价氧化物对应水化物的酸性强弱X>Y>Z | |
| D. | 单质与氢气反应,X、Y、Z难度依次增大 |
7.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 30 g C2H6中含有的化学键数目为8NA | |
| B. | 1 L0.1mol•L-1醋酸溶液中含有的H+数为0.1 NA | |
| C. | 78 g Na2O2;和Na2S的混合物中含有的阴离子数目为NA | |
| D. | 2.24 L CI2与足量铁粉在一定条件下充分反应,转移电子数为0.2 NA |
8.表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号.
(2)表中元素②⑥⑩氢化物的稳定性最强的是:HF (填写化学式,下同),最高价氧化物对应水化物的酸性最强的是:HClO4;
(3)表中元素①③⑧最高价氧化物对应水化物的碱性最强的是:KOH;
(4)表中元素③⑤⑦最高价氧化物对应水化物两两反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O、H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑦ | ⑥ | ||
| 四 | ⑧ | ⑨ | ⑩ |
(2)表中元素②⑥⑩氢化物的稳定性最强的是:HF (填写化学式,下同),最高价氧化物对应水化物的酸性最强的是:HClO4;
(3)表中元素①③⑧最高价氧化物对应水化物的碱性最强的是:KOH;
(4)表中元素③⑤⑦最高价氧化物对应水化物两两反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O、H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O.