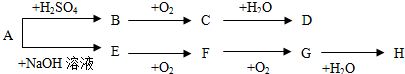题目内容
16.下列说法正确的是( )| A. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| B. | 所有化学变化的能量都可以通过原电池转化为电能 | |
| C. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| D. | 凡是需要加热的反应都是吸热反应 |
分析 A、根据物质三态之间的转变也存在热量的变化,如固态的水变为气态时吸收热量,但属于物理变化;
B、根据原电池中进行的反应为自发进行的氧化还原反应,还有部分热量以其它形式转化;
C、根据化学反应中不仅质量守恒而且能量守恒也守恒;
D、放吸热反应与反应物与生成物总能量的相对大小有关,与反应条件无关.
解答 解:A、因物质三态之间的转变也存在热量的变化,而物质三态之间的转变是物理变化,故A错误;
B、只有自发进行的氧化还原反应,通过反应将化学能转变为热能,故B错误;
C、因化学反应中不仅质量守恒而且能量守恒也守恒,故C正确;
D、放吸热反应与反应物与生成物总能量的相对大小有关,与反应条件无关,故D错误.
故选:C.
点评 本题需要强调的是化学变化一定会引起物质种类的变化,体系内物质种类变化不一定发生了化学变化,如核聚变和裂变.

练习册系列答案
相关题目
6.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 酸性溶液中:K+、MnO4+、SO42-Cl- | |
| B. | 能使甲基橙显红色的溶液:Fe2+,NO3-,Na+,SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=l0-12的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 酸性透明溶液中:Cu2+、Al3+、SO42-、NO3- |
7.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 30 g C2H6中含有的化学键数目为8NA | |
| B. | 1 L0.1mol•L-1醋酸溶液中含有的H+数为0.1 NA | |
| C. | 78 g Na2O2;和Na2S的混合物中含有的阴离子数目为NA | |
| D. | 2.24 L CI2与足量铁粉在一定条件下充分反应,转移电子数为0.2 NA |
4.加热蒸发下列溶液,可以得到其溶质的是( )
| A. | AlCl3(aq) | B. | Al2(SO4)3(aq) | C. | HCl(aq) | D. | NaHCO3(aq) |
11.从柑桔中炼制萜二烯 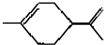 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H18 | |
| D. | 与过量的溴的CCl4溶液反应后产物为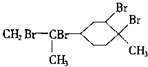 |
1.已知断开lmolH一H键吸收的能量为436kJ,形成lmolH一N键放出的能量为39lKJ,根据化学方程式N2+3H2$?_{催化剂}^{高温高压}$2NH3,反应完1mol N2放出的能量为92.4kJ,则断开1mol N≡N键需吸收的能量是( )
| A. | 431kJ | B. | 945.6kJ | C. | 649kJ | D. | 869kJ |
8.表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号.
(2)表中元素②⑥⑩氢化物的稳定性最强的是:HF (填写化学式,下同),最高价氧化物对应水化物的酸性最强的是:HClO4;
(3)表中元素①③⑧最高价氧化物对应水化物的碱性最强的是:KOH;
(4)表中元素③⑤⑦最高价氧化物对应水化物两两反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O、H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑦ | ⑥ | ||
| 四 | ⑧ | ⑨ | ⑩ |
(2)表中元素②⑥⑩氢化物的稳定性最强的是:HF (填写化学式,下同),最高价氧化物对应水化物的酸性最强的是:HClO4;
(3)表中元素①③⑧最高价氧化物对应水化物的碱性最强的是:KOH;
(4)表中元素③⑤⑦最高价氧化物对应水化物两两反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O、H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O.
5.下列关于离子化合物的叙述正确的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 共价化合物也能含有离子键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |