题目内容
8.二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]•2H2O}制备流程如下: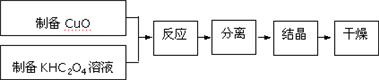
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①过滤所需的玻璃仪器有漏斗、烧杯、玻璃棒
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀,说明已洗涤干净
(2)①为提高CuO的利用率,让滤纸上的CuO充分转移到热的KHC2O4溶液中,以下方案正确的是ad
a.剪碎滤纸,加入到热的KHC2O4溶液中,待充分反应后趁热过滤
b.用稀硫酸溶解滤纸上的氧化铜,然后将溶液转入热的KHC2O4溶液中
c.用氢氧化钾溶液溶解氧化铜,并转入热的KHC2O4溶液中
d.在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液
②50℃水浴加热至反应充分,发生反应的化学方程式为2KHC2O4+CuO$\frac{\underline{\;50℃\;}}{\;}$K2[Cu(C2O4)2]+H2O;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体.
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,此反应进行的主要原因是草酸的酸性强于碳酸.
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到.从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗; b.降低硫酸铜的溶解度,有利于硫酸铜晶体析出.
②在蒸发浓缩的初始阶段还采用了蒸馏的操作,其目的是回收乙醇.
分析 (1)①根据过滤装置所需的玻璃仪器答题;
②CuO表面会附着硫酸根离子,用氯化钡溶液检验最后一次洗涤液中是否含有硫酸根离子判断是否洗涤干净;
(2)①过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸或将滤纸灼烧成灰再将剩余的固体转入热的KHC2O4溶液;
②CuO与KHC2O4溶液在50℃水浴加热条件下反应生成K2[Cu(C2O4)2]与H2O;
(3)由于草酸的酸性强于碳酸,所以可以用K2CO3粉末与草酸溶液反应制备KHC2O4;
(4)从硫酸铜溶液中获得硫酸铜晶体时,为减少硫酸铜的溶解,可用加入少量乙醇,并用蒸馏的方法分离乙醇.
解答 解:(1)①过滤装置所需的玻璃仪器有漏斗、烧杯、玻璃棒,故答案为:漏斗、烧杯、玻璃棒;
②CuO表面会附着硫酸根离子,检验是否洗涤干净的具体方法是:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀,说明已洗涤干净,
故答案为:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀,说明已洗涤干净;
(2)①过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸或将滤纸灼烧成灰再将剩余的固体转入热的KHC2O4溶液,故选ad;
②根据题意可知,CuO与KHC2O4溶液在50℃水浴加热条件下反应生成K2[Cu(C2O4)2]与H2O,反应的方程式为:2KHC2O4+CuO$\frac{\underline{\;50℃\;}}{\;}$K2[Cu(C2O4)2]+H2O,
故答案为:2KHC2O4+CuO$\frac{\underline{\;50℃\;}}{\;}$K2[Cu(C2O4)2]+H2O;
(3)由于草酸的酸性强于碳酸,所以可以用K2CO3粉末与草酸溶液反应制备KHC2O4,故答案为:草酸的酸性强于碳酸;
(4)①从硫酸铜溶液中获得硫酸铜晶体时,为减少硫酸铜的溶解,降低硫酸铜的溶解度,有利于硫酸铜晶体析出,可用加入少量乙醇,
故答案为:降低硫酸铜的溶解度,有利于硫酸铜晶体析出;
②在蒸发浓缩的初始阶段还采用了蒸馏的方法,可起到回收乙醇的作用,故答案为:回收乙醇.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理和操作,难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.其化学式为:FeSO4•(NH4)2SO4•6H2O 硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为ABCD(填序号)
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++H2S═2Fe2++S↓+2H+ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC(填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO?4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在酸式(填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.



 .
.