题目内容
3.硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置如下图,制取方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.(1)本实验对Na2S的纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤为:
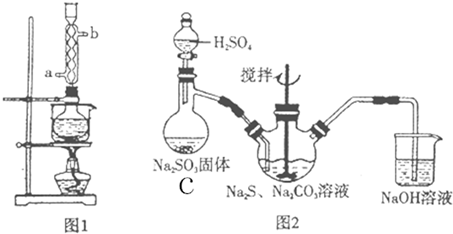
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图1所示装配所需仪器,向冷凝管的a处(填a或b)通入冷却水,同时水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤
⑤冷却结晶,过滤(填操作名称)
⑥将所得固体洗涤、干燥,得到Na2S2O3•9H2O晶体.
(2)用图2所示装置制取Na2S2O3,其中NaOH溶液的作用是吸收SO2等有害气体,防止污染空气装置C中制SO2的方程式为:H2SO4+Na2SO3=Na2SO4+SO2+H2O如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有可能出现浑浊,写出该反应的化学方程式:4HCl+2Na2S+SO2=4NaCl+3S↓+2H2O
(3)用该方法获得的Na2S2O3.H2O晶体中常混有一定量的杂质.为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,再过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4.
分析 (1)②根据采用逆流冷却的效果好判断进水口;
⑤热的滤液冷却结晶过滤得到晶体;
(2)制备过程中需要制备二氧化硫进行反应生成硫代硫酸钠,二氧化硫是污染性气体不能排放空气中,需要用氢氧化钠溶液吸收;装置C中用浓硫酸与亚硫酸钠反应生成二氧化硫;若换成盐酸除了反应生成硫代硫酸钠外还有氯化钠;
(3)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl;硝酸、硫酸、盐酸等性质比较可知.
解答 解:(1)②根据采用逆流冷却的效果好可知,则应向冷凝管的a处通入水,
故答案为:a;
⑤热的滤液通过冷却、结晶、过滤得到晶体,
故答案为:冷却结晶,过滤;
(2)装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气;装置C中用浓硫酸与亚硫酸钠反应生成二氧化硫,反应的方程式为H2SO4+Na2SO3=Na2SO4+SO2+H2O,换做盐酸进行反应产物中除了硫代硫酸盐外,在酸性条件下发生反应生成单质硫和氯化钠,反应的方程式为4HCl+2Na2S+SO2=4NaCl+3S↓+2H2O,
故答案为:吸收SO2等有害气体,防止污染空气;H2SO4+Na2SO3=Na2SO4+SO2+H2O;4HCl+2Na2S+SO2=4NaCl+3S↓+2H2O;
(3)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,
故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸.
点评 本题考查了物质制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用,掌握基础,侧重于学生的分析能力、实验能力的考查,为高考常见题型和高频考点,注意把握物质的性质以及实验原理的探究,题目难度中等.

C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
(1)第②步中所加CaCO3还发生了其它反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
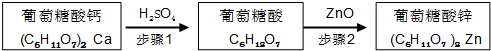
步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
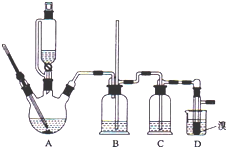 实验室制备 1,2-二溴乙烷的反应原理如下:
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2+H2OC H2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目的是d;(填正确选 项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母) a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去(填正确选项前的字母);
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去蒸馏;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.