题目内容
17. 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.其化学式为:FeSO4•(NH4)2SO4•6H2O 硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
回答下列问题:
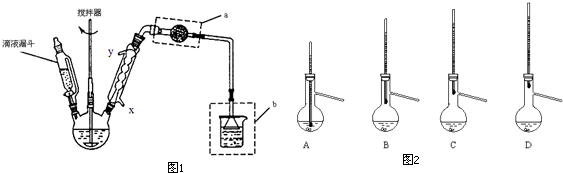
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为ABCD(填序号)
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++H2S═2Fe2++S↓+2H+ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC(填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO?4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在酸式(填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.
分析 Ⅰ.(1)氢氧化钠溶液在加热条件下能使油污发生水解;
(2)铁屑中含有铁锈(Fe2O3)、FeS等,都与硫酸发生反应,反应后的产物Fe3+与S2-、Fe2+也可以发生氧化还原反应;
(3)亚铁离子能被空气中的氧气氧化,氢氧化钠溶液能吸收含杂质的铁屑与硫酸反应产生的硫化氢气体,防止污染空气;
Ⅱ.在溶液中溶解度小的物质先析出;从溶液中析出的硫酸亚铁铵晶体表面有硫酸、水等杂质,需要除杂、干燥;
Ⅲ.KMnO4溶液有强氧化性,容易氧化橡皮;高锰酸钾溶液滴入亚铁盐溶液中,高锰酸钾溶液会褪色,如果高锰酸钾溶液的颜色不褪色说明加入的高锰酸钾溶液已经足量,据此电子得失守恒得关系式5FeSO4~KMnO4,可以计算出FeSO4的质量,再根据 $\frac{FeS{O}_{4}}{样品的质量}$×100%得到晶体中FeSO4的质量分数.
解答 解:Ⅰ.(1)氢氧化钠溶液在加热条件下能使油污发生水解,所以用氢氧化钠溶液煮沸的目的是除去铁屑中油污,故答案为:除去铁屑中油污;
(2)铁屑中含有铁锈(Fe2O3)、FeS等,都与硫酸发生反应,反应后的产物Fe3+与S2-、Fe2+也可以发生氧化还原反应,故选:ABCD;
(3)亚铁离子能被空气中的氧气氧化,所以要通入氢气,排除空气,防止亚铁离子被氧气氧化,氢氧化钠溶液能吸收含杂质的铁屑与硫酸反应产生的硫化氢气体,防止污染空气,所以利用容器②的反应,向容器①中通入氢气,应先将气体通过氢氧化钠溶液,再通入容器①,所以应关闭活塞A,打开活塞BC,
故答案为:A;BC;吸收硫化氢气体,防止污染空气;防止亚铁离子被氧气氧化;
Ⅱ.根据表中的数据可知,硫酸亚铁、硫酸铵、硫酸亚铁铵三种物质中,硫酸亚铁铵的溶解度最小,所以硫酸亚铁铵在溶液中先析出,从溶液中析出的硫酸亚铁铵晶体表面有硫酸、水等杂质,需要除杂、干燥,所以从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥,
故答案为:硫酸亚铁铵的溶解度最小;过滤、用酒精洗涤、干燥;
Ⅲ.KMnO4溶液有强氧化性,容易氧化橡皮,所以将KMnO4溶液装在酸式滴定管中,高锰酸钾溶液滴入亚铁盐溶液中,高锰酸钾溶液会褪色,如果高锰酸钾溶液的颜色不褪色说明加入的高锰酸钾溶液已经足量,所以反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变,据此电子得失守恒得关系式5FeSO4~KMnO4,可以计算出FeSO4的质量为5×0.5mo1•L-1×0.02L×152g/mol=7.6g,所以FeSO4的质量分数=$\frac{FeS{O}_{4}}{样品的质量}$×100%=$\frac{7.6}{20}$×100%=38%,
故答案为:酸式;溶液刚出现紫红色,保持30s不变;38%.
点评 本题以莫尔盐的制备为载体,考察氧化还原反应、氧化还原反应滴定应用、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目有一定的难度,注意基础知识的全面掌握.

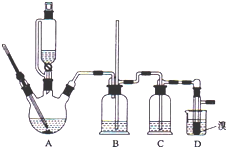 实验室制备 1,2-二溴乙烷的反应原理如下:
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2+H2OC H2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目的是d;(填正确选 项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母) a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去(填正确选项前的字母);
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去蒸馏;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH
(3)A、B、C、G的离子按离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅢA族.
(6)有两种化合物M和N都由AFIJ四种元素组成.若M与N在水溶液中能发生离子反应,则该反应的离子方程式为HSO3-+H+=H2O+SO2↑.
(7)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
| A. | 工厂利用高压电除尘,有利于减轻雾霾和预防大气污染 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 过滤泥水混合物,用激光笔照射滤液,能产生光亮的通路 | |
| D. | 江河入海出容易形成三角洲,如长江三角洲和黄河三角洲的形成 |

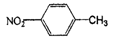
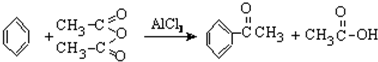 (乙酸酐)制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑等副反应.
(乙酸酐)制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑等副反应.