题目内容
按要求填空
(一)X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最外层电子数相同.回答下列问题:
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式 ;
(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键.此化合物可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为
(二),在一定条件下,RO3nˉ 和Iˉ发生反应,离子方程式为:RO3nˉ+6Iˉ+6H+═Rˉ+3I2+3H2O
RO3n-中R元素的化合价为 ,R元素的原子最外层电子有 个.
(三)、Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
(四)、已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为 .
(一)X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最外层电子数相同.回答下列问题:
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式
(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键.此化合物可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为
(二),在一定条件下,RO3nˉ 和Iˉ发生反应,离子方程式为:RO3nˉ+6Iˉ+6H+═Rˉ+3I2+3H2O
RO3n-中R元素的化合价为
(三)、Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
(四)、已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为
考点:位置结构性质的相互关系应用,根据化学式判断化合价,氧化还原反应的计算
专题:氧化还原反应专题,元素周期律与元素周期表专题
分析:(一)X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,则X为H元素;Y的一种单质具有特殊臭味,则Y为O元素;Z与X原子最外层电子数相同,Z原子序数大于O元素,则Z为Na;
(二)根据离子方程式中电荷守恒计算n的值,再根据化合价代数和等于离子所带电荷计算R的化合价;根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第七主族元素;
(三)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,S元素化合价由-
升高为+6,而NaClO被还原为NaCl,Cl元素化合价由+1价降低为-1价,反应中Na2Sx与NaClO的物质的量之比为1:16,根据电子转移守恒,列方程计算x的值;
(四)设M2On2-中M的化合价为x,则2x+2=2n,故x=n-1,结合氧化还原反应中氧化剂和还原剂转移电子数目相等列方程计算.
(二)根据离子方程式中电荷守恒计算n的值,再根据化合价代数和等于离子所带电荷计算R的化合价;根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第七主族元素;
(三)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,S元素化合价由-
| 2 |
| x |
(四)设M2On2-中M的化合价为x,则2x+2=2n,故x=n-1,结合氧化还原反应中氧化剂和还原剂转移电子数目相等列方程计算.
解答:
解:(一)X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,则X为H元素;Y的一种单质具有特殊臭味,则Y为O元素;Z与X原子最外层电子数相同,Z原子序数大于O元素,则Z为Na;
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物为NaOH,其电子式为 ,
,
故答案为: ;
;
(2)H和O组成的化合物中,有一种既含有极性共价键又含有非极性共价键,该化合物为H2O2,H2O2可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3,
故答案为:H2O2+CN-+OH-=CO32-+NH3;
(二)根据离子方程式遵循电荷守恒可知:(-n)+(-6)+6=-1,可知n=1,设RO3n-离子中R的化合价为x,则:(x-2×3)=-1,解得x=+5,
RO3n-中R元素的化合价不一定为最高正价,应根据反应物中R-离子的化合价进行判断,根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第七主族元素,最外层电子数为7,
故答案为:+5;7;
(三)解:Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,S元素化合价由-
升高为+6,而NaClO被还原为NaCl,Cl元素化合价由+1价降低为-1价,反应中Na2Sx与NaClO的物质的量之比为1:16,根据电子转移守恒,则:x×[6-(-
)]=16×[1-(-1)],解得:x=5,
故答案为:5;
(四)n(M2On2-)=0.3mol/L×0.1L=0.03mol,n(R2-)=0.6mol×0.15L=0.09mol,
设M2On2-中M的化合价为x,则2x+2=2n,故x=n-1,反应中M氧化化合价降低到+3价,R元素化合价升高到0价,氧化还原反应中氧化剂和还原剂转移电子数目相等,则有(n-1-3)×0.03mol×2=(2-0)×0.09mol,解得n=7,
故答案为:7.
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物为NaOH,其电子式为
 ,
,故答案为:
 ;
;(2)H和O组成的化合物中,有一种既含有极性共价键又含有非极性共价键,该化合物为H2O2,H2O2可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3,
故答案为:H2O2+CN-+OH-=CO32-+NH3;
(二)根据离子方程式遵循电荷守恒可知:(-n)+(-6)+6=-1,可知n=1,设RO3n-离子中R的化合价为x,则:(x-2×3)=-1,解得x=+5,
RO3n-中R元素的化合价不一定为最高正价,应根据反应物中R-离子的化合价进行判断,根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第七主族元素,最外层电子数为7,
故答案为:+5;7;
(三)解:Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,S元素化合价由-
| 2 |
| x |
| 2 |
| x |
故答案为:5;
(四)n(M2On2-)=0.3mol/L×0.1L=0.03mol,n(R2-)=0.6mol×0.15L=0.09mol,
设M2On2-中M的化合价为x,则2x+2=2n,故x=n-1,反应中M氧化化合价降低到+3价,R元素化合价升高到0价,氧化还原反应中氧化剂和还原剂转移电子数目相等,则有(n-1-3)×0.03mol×2=(2-0)×0.09mol,解得n=7,
故答案为:7.
点评:本题属于拼合型题目,为高考常见题型,涉及结构性质位置关系、离子方程式计算、氧化还原反应有关计算等,侧重于学生的分析能力和计算能力的考查,难度不大,注意氧化还原反应中转移电子数目相等.

练习册系列答案
相关题目
对人体健康不会造成危害的是( )
| A、用工业酒精(含甲醇)兑制饮用酒 |
| B、用食醋除去水壶内壁的水垢 |
| C、用甲醛水溶液浸泡海产品进行防腐保鲜 |
| D、在不通风、无防护的条件下用苯做实验 |
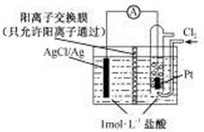 某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A、正极反应为AgCl+e-═Ag+Cl- |
| B、放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C、若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D、当电路中转移0.01mol e-时,交换膜左则溶液中约减少0.02mol离子 |
根据原子结构及元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
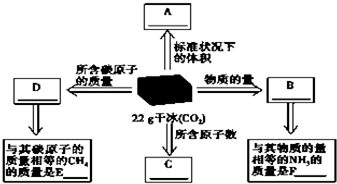 (1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.
(1)干冰是固态CO2的俗称,常用做人工降雨,22g干冰与A、B、C、D有如图所示的转化关系,请完成图中方框.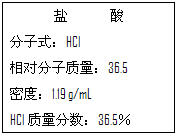 如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题: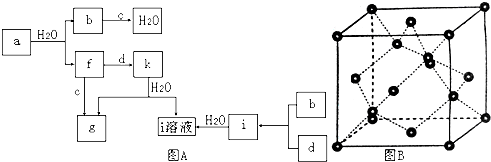
 I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)