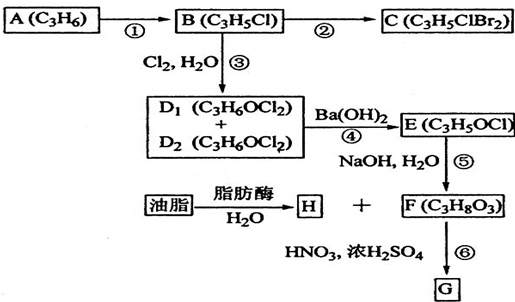
题目内容
 I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)| 加热 |
| 催化剂 |
(1)此反应是工业上生产
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量.
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
②写出此反应的热化学方程式:
2SO2(g)十O2(g)?2SO3(g)△H=
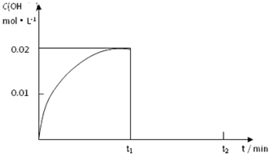
Ⅱ.(1)在某温度下,把1.00mol NH3溶于水中配成1.00L溶液,测得溶液中OH-浓度和时间的图象如下:
①求该温度时,氨水的电离平衡常数K=
②在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线.
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性.
①a
②根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3?H2O)=
考点:化学平衡状态的判断,热化学方程式,化学平衡常数的含义,酸碱混合时的定性判断及有关ph的计算
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:Ⅰ、(1)二氧化硫的催化氧化是制备硫酸的重要步骤;
(2)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化,做题时要注意方程式前后气体的化学计量数的关系;
(3)①计算常压下的二氧化硫转化率分析判断;
②计算对应反应的焓变,依据热化学方程式书写方法写出;
Ⅱ、(1)①依据电离平衡常数概念列式计算;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小;
(2)①依据盐酸和氨水恰好反应生成氯化铵溶液呈酸性,若溶液呈中性氨水过量;
②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
计算;
(2)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化,做题时要注意方程式前后气体的化学计量数的关系;
(3)①计算常压下的二氧化硫转化率分析判断;
②计算对应反应的焓变,依据热化学方程式书写方法写出;
Ⅱ、(1)①依据电离平衡常数概念列式计算;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小;
(2)①依据盐酸和氨水恰好反应生成氯化铵溶液呈酸性,若溶液呈中性氨水过量;
②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
解答:
解:(1)二氧化硫的催化氧化是制备硫酸的重要步骤;
故答案为:硫酸;
(2)a、每生成1mol SO3的同时生成0.5mol O2,说明正逆反应速率相等,反应达到平衡状态,故a正确;
b、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故b错误;
c、SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故c错误;
d、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故d正确;
故选:ad;
(3)①在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量,反应过程中二氧化硫的转化率=
×100%=96%,在常压下,此反应的转化率已经达到96%,没有必要再增大压强了;
故答案为:在常压下,此反应的转化率已经达到96%,没有必要再增大压强了;
②依据题意可知反应0.96mol放热190.08KJ,2mol二氧化硫反应放热396KJ,热化学方程式2SO2(g)十O2(g)?2SO3(g)△H=-396KJ/mol;
故答案为:-396kJ/mo1;
II.(1)①在某温度下,把1.00mol NH3溶于水中配成1.00L溶液,测得溶液中OH-浓度和时间的图象中平衡状态下氢氧根离子浓度为0.02mol/L;
平衡常数K=
=
=4.00×10-4;
故答案为:4.00×10-4;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小;画出的图象为: ;
;
故答案为: ;
;
(2)①依据盐酸和氨水恰好反应生成氯化铵溶液呈酸性,若溶液呈中性氨水过量a<b;
故答案为:<;
②求混合后溶液中剩余氨水浓度设为C,依据平衡常数概念计算,将b mol?L-1的氨水与a mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,c(NH4+)=c(Cl-)=
mol/L,c=
mol/L-
mol/L=
mol/L;
故答案为:
mol/L;
故答案为:硫酸;
(2)a、每生成1mol SO3的同时生成0.5mol O2,说明正逆反应速率相等,反应达到平衡状态,故a正确;
b、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故b错误;
c、SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故c错误;
d、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故d正确;
故选:ad;
(3)①在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量,反应过程中二氧化硫的转化率=
| 1.00mol-0.04mol |
| 1.00mol |
故答案为:在常压下,此反应的转化率已经达到96%,没有必要再增大压强了;
②依据题意可知反应0.96mol放热190.08KJ,2mol二氧化硫反应放热396KJ,热化学方程式2SO2(g)十O2(g)?2SO3(g)△H=-396KJ/mol;
故答案为:-396kJ/mo1;
II.(1)①在某温度下,把1.00mol NH3溶于水中配成1.00L溶液,测得溶液中OH-浓度和时间的图象中平衡状态下氢氧根离子浓度为0.02mol/L;
平衡常数K=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| 0.02mol/L×0.02mol/L |
| 1mol/L-0.02mol/L |
故答案为:4.00×10-4;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小;画出的图象为:
 ;
;故答案为:
 ;
;(2)①依据盐酸和氨水恰好反应生成氯化铵溶液呈酸性,若溶液呈中性氨水过量a<b;
故答案为:<;
②求混合后溶液中剩余氨水浓度设为C,依据平衡常数概念计算,将b mol?L-1的氨水与a mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,c(NH4+)=c(Cl-)=
| a |
| 2 |
| b |
| 2 |
| a |
| 2 |
| b-a |
| 2 |
故答案为:
| b-a |
| 2 |
点评:本题考查了化学平衡影响因素分析,平衡常数计算应用,弱电解质电离平衡的分析计算,掌握基础是关键,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目