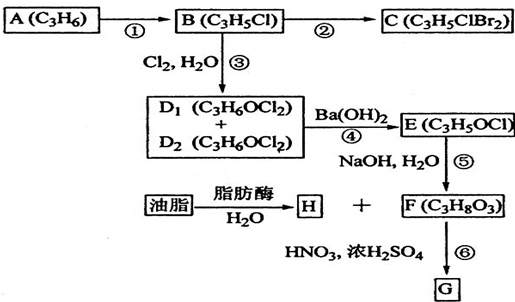
题目内容
(一)BaCl2?xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g.
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;
(2)计算BaCl2?xH2O中的x= (取整数值).
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”).
(二)图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示.且该物质为自然界最硬的物质.
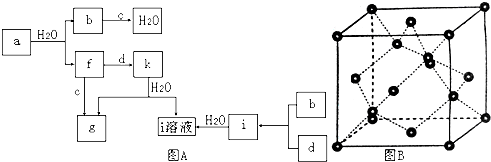
回答下列问题:
(1)图B对应的物质名称是 ,
(2)d中元素的原子核外电子排布式为 .
(3)图A中由二种元素组成的物质中,沸点最高的是 ,
(4)图A中的双原子分子中,极性最大的分子是 ,
(5)k的分子式为 .
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g.
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和
(2)计算BaCl2?xH2O中的x=
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果
(二)图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示.且该物质为自然界最硬的物质.

回答下列问题:
(1)图B对应的物质名称是
(2)d中元素的原子核外电子排布式为
(3)图A中由二种元素组成的物质中,沸点最高的是
(4)图A中的双原子分子中,极性最大的分子是
(5)k的分子式为
考点:无机物的推断,探究物质的组成或测量物质的含量
专题:推断题,化学键与晶体结构,元素及其化合物
分析:(一)由整个操作可知,通过测定生成硫酸钡沉淀的质量确定晶体中氯化钡的质量,进而测定晶体中x的值,
(1)应用硫酸与蒸馏水进行进行沉淀洗涤;
(2)根据硫酸钡质量计算氯化钡质量,进而计算水的质量,根据二者质量之比确定x的值;
(3)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大;
(二)a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,且该物质为自然界最硬的物质,判断为金刚石,则a为C,故b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2,据此解答.
(1)应用硫酸与蒸馏水进行进行沉淀洗涤;
(2)根据硫酸钡质量计算氯化钡质量,进而计算水的质量,根据二者质量之比确定x的值;
(3)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大;
(二)a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,且该物质为自然界最硬的物质,判断为金刚石,则a为C,故b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2,据此解答.
解答:
解:(一)由整个操作可知,通过测定生成硫酸钡沉淀的质量确定晶体中氯化钡的质量,进而测定晶体中x的值,
(1)应用硫酸与蒸馏水进行进行沉淀洗涤,故答案为:蒸馏水;
(2)沉淀1.165g为硫酸钡质量,其物质的量=
=0.005mol,故氯化钡晶体中氯化钡的质量=0.005mol×208g/mol=1.04g,含有结晶水的质量=1.222g-1.04g=0.182g,则208:18x=1.04g:0.182g,解得x≈2,
故答案为:2;
(3)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大,故x的值偏高,
故答案为:偏高;
(二)a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,且该物质为自然界最硬的物质,判断为金刚石,则a为C,则b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2,
(1)由上述分析可知,图B对应的物质为金刚石,故答案为:金刚石;
(2)d中元素为Cl元素,基态原子电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
(3)所有两元素形成的物质中,水分子之间存在氢键,常温下是液态,其它都是气体,故水的沸点最高,故答案为:H2O;
(4)所有双原子分子中,只有H、Cl电负性差值最大,因而HCl的极性最大,故答案为:HCl;
(5)由上述分析可知,k的分子式为COCl2,故答案为:COCl2.
(1)应用硫酸与蒸馏水进行进行沉淀洗涤,故答案为:蒸馏水;
(2)沉淀1.165g为硫酸钡质量,其物质的量=
| 1.165g |
| 233g/mol |
故答案为:2;
(3)部分沉淀被滤纸中的碳还原为BaS,单质固体硫酸钡的质量偏小,测定氯化钡的质量偏小,水的质量偏大,故x的值偏高,
故答案为:偏高;
(二)a、b、c和d分别为四种短周期元素的常见单质,b与c反应生成水,故b、c分别为H2、O2中的一种,a的一种同素异形体的晶胞中每个原子周围有4个键,且该物质为自然界最硬的物质,判断为金刚石,则a为C,则b为H2、c为O2,由转化关系可知,f为CO,g为CO2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2,i为HCl,而k与水反应生成CO2与盐酸,该反应没在教材中出现过,且由f、d反应得到,应含C、O、Cl三种元素,只能判断为COCl2,
(1)由上述分析可知,图B对应的物质为金刚石,故答案为:金刚石;
(2)d中元素为Cl元素,基态原子电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5;
(3)所有两元素形成的物质中,水分子之间存在氢键,常温下是液态,其它都是气体,故水的沸点最高,故答案为:H2O;
(4)所有双原子分子中,只有H、Cl电负性差值最大,因而HCl的极性最大,故答案为:HCl;
(5)由上述分析可知,k的分子式为COCl2,故答案为:COCl2.
点评:本题考查物质组成的测定、无机物推断,属于拼合型题目,对应(一)理解测定原理是解题关键,(二)中关键根据晶胞结构判断b,k分子式的确定是难点,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
配制一定体积、一定物质的量浓度的溶液时,下列会使配得的溶液浓度偏低的是( )
| A、容量瓶中原有少量蒸馏水 |
| B、溶液从烧杯转移到容量瓶中后没有洗涤烧杯和玻璃棒 |
| C、定容时观察液面俯视 |
| D、定容时平视液面 |
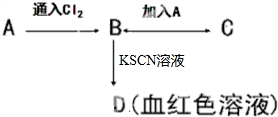 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.