题目内容
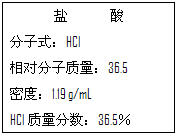 如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:(1)该浓盐酸的物质的量浓度是
(2)取用任意体积的该盐酸时,下列物理量不随所取体积的多少而变化的是
A、溶液中HCl的物质的量 B、溶液的物质的量浓度
C、溶液中Cl-的数目 D、溶液的密度
(3)某同学欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.4mol/L的稀盐酸.
①该学生需要量取
②本实验用到的基本仪器有:
③在配制过程中,下列实验操作对所配的稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”、“无影响”)
I、未洗涤烧杯和玻璃棒
Ⅱ、定容时俯视刻度线
Ⅲ、容量瓶使用前瓶内有少量蒸馏水
Ⅳ、定容后经倒转摇匀,发现液面下降,再加适量蒸馏水
V、转移时不小心把液体溅到了容量瓶外
考点:物质的量浓度的相关计算,配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据c=
计算;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化;
(3)①根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;
②根据配制一定体积物质的量浓度的溶液的步骤选择使用的仪器;
③分析操作对溶质物质的量、溶液体积的影响,根据c=
判断对所配溶液浓度的影响.
| 1000ρw |
| M |
(2)溶液是均匀的,溶液的密度、浓度不随体积变化;
(3)①根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;
②根据配制一定体积物质的量浓度的溶液的步骤选择使用的仪器;
③分析操作对溶质物质的量、溶液体积的影响,根据c=
| n |
| V |
解答:
解:(1)质量分数36.5%、密度1.19g/mL 浓盐酸的物质的量浓度=
mol/L=11.9mol/L,
故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关,
故答案为:BD;
(3)①令需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:
V×10-3L×11.9mol/L=0.5 L×0.400mol/L,解得:V=16.8,
故答案为:16.8;
②配制500mL浓度为0.4mol?L-1的稀盐酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
③I.未洗涤烧杯和玻璃棒,移入容量瓶内HCl的物质的量减小,所配溶液浓度偏低;
Ⅱ.定容时俯视刻度线,液面再刻度线下方,溶液的体积偏小,所配溶液浓度偏高;
Ⅱ.溶液配制需加水定容,配制时,容量瓶有少量蒸馏水对所配溶液浓度无影响;
Ⅳ.定容后经振荡、摇匀,发现液面下降,少量溶液残留在瓶口与瓶塞之间,再加适量的蒸馏水,导致溶液体积偏大,所配溶液浓度偏低;
V.转移时不小心把液体溅到了容量瓶外,移入容量瓶内HCl的物质的量减小,所配溶液浓度偏低,
故答案为:偏低;偏高;无影响;偏低;偏低.
| 1000×1.19×36.5% |
| 36.5 |
故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关,
故答案为:BD;
(3)①令需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:
V×10-3L×11.9mol/L=0.5 L×0.400mol/L,解得:V=16.8,
故答案为:16.8;
②配制500mL浓度为0.4mol?L-1的稀盐酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
③I.未洗涤烧杯和玻璃棒,移入容量瓶内HCl的物质的量减小,所配溶液浓度偏低;
Ⅱ.定容时俯视刻度线,液面再刻度线下方,溶液的体积偏小,所配溶液浓度偏高;
Ⅱ.溶液配制需加水定容,配制时,容量瓶有少量蒸馏水对所配溶液浓度无影响;
Ⅳ.定容后经振荡、摇匀,发现液面下降,少量溶液残留在瓶口与瓶塞之间,再加适量的蒸馏水,导致溶液体积偏大,所配溶液浓度偏低;
V.转移时不小心把液体溅到了容量瓶外,移入容量瓶内HCl的物质的量减小,所配溶液浓度偏低,
故答案为:偏低;偏高;无影响;偏低;偏低.
点评:本题考查物质的量浓度计算、一定物质的量浓度溶液配制等,难度不大,注意根据c=
理解溶液配制原理及进行误差分析.
| n |
| V |

练习册系列答案
相关题目
下列有关金属及化合物的说法正确的是( )
| A、地壳中含量最多的元素是铝元素 |
| B、在自然界中铝以化合态存在 |
| C、NaCl的焰色反应呈紫色 |
| D、白色絮状沉淀Fe(OH)2可溶于NaOH溶液中 |
某校化学兴趣小组的同学将等体积的甲烷与氯气混合于一集气瓶中,用玻璃片盖严后置于光亮处,一段时间后不可能观察到的现象是( )
| A、集气瓶中气体的黄绿色逐渐变浅 |
| B、集气瓶内壁上有油状液滴附着 |
| C、集气瓶底部出现黑色颗粒 |
| D、取下玻璃片,可能会看到白雾 |
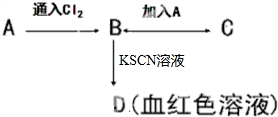 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.