题目内容
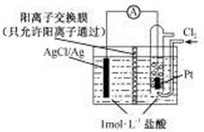 某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A、正极反应为AgCl+e-═Ag+Cl- |
| B、放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C、若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D、当电路中转移0.01mol e-时,交换膜左则溶液中约减少0.02mol离子 |
考点:化学电源新型电池
专题:电化学专题
分析:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子;
B、放电时,交换膜左侧溶液中生成银离子;
C、根据电池总反应判断;
D、放电时,交换膜左则的氢离子向正极移动,氯离子与银离子生成氯化银沉淀.
A、正极上氯气得电子;
B、放电时,交换膜左侧溶液中生成银离子;
C、根据电池总反应判断;
D、放电时,交换膜左则的氢离子向正极移动,氯离子与银离子生成氯化银沉淀.
解答:
解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B、放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故B错误;
C、根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D、放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确.
故选:D.
A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B、放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故B错误;
C、根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D、放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确.
故选:D.
点评:本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
运用相关化学知识进行判断,下列结论错误的是( )
| A、某吸热反应能自发进行,因此该反应是熵增反应 |
| B、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C、可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D、增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率 |
下列有关金属及化合物的说法正确的是( )
| A、地壳中含量最多的元素是铝元素 |
| B、在自然界中铝以化合态存在 |
| C、NaCl的焰色反应呈紫色 |
| D、白色絮状沉淀Fe(OH)2可溶于NaOH溶液中 |
配制一定体积、一定物质的量浓度的溶液时,下列会使配得的溶液浓度偏低的是( )
| A、容量瓶中原有少量蒸馏水 |
| B、溶液从烧杯转移到容量瓶中后没有洗涤烧杯和玻璃棒 |
| C、定容时观察液面俯视 |
| D、定容时平视液面 |
下列选项中对应关系正确的是( )
A、CH3CH3+Cl2
| ||
| B、由油脂得到甘油,由淀粉得到葡萄糖;均发生了水解反应 | ||
| C、Cl2+2Br-═2Cl-+Br2,Zn+Cu2+═Zn2++Cu,均为单质被还原的置换反应 | ||
| D、2Na2O2+2H2O═4NaOH+O2↑,Cl2+H2O═HCl+HClO,均为水作还原剂的氧化还原反应 |
下列说法正确的是( )
| A、2-丁烯不存在顺反异构体 |
| B、已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种 |
C、菲的结构简式为 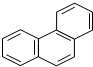 ,它与硝酸反应,可生成4种一硝基取代物 ,它与硝酸反应,可生成4种一硝基取代物 |
| D、乙醛的核磁共振氢谱中有二个峰,峰面积之比是1:3 |
某校化学兴趣小组的同学将等体积的甲烷与氯气混合于一集气瓶中,用玻璃片盖严后置于光亮处,一段时间后不可能观察到的现象是( )
| A、集气瓶中气体的黄绿色逐渐变浅 |
| B、集气瓶内壁上有油状液滴附着 |
| C、集气瓶底部出现黑色颗粒 |
| D、取下玻璃片,可能会看到白雾 |