题目内容
根据原子结构及元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A.同主族元素最高价含氧酸自上而下酸性减弱;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C.电子层结构相同,核电荷数越大离子半径越小;
D.互为同位素原子的化学性质几乎完全相同.
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C.电子层结构相同,核电荷数越大离子半径越小;
D.互为同位素原子的化学性质几乎完全相同.
解答:
解:A.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故A错误;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.3517Cl与3717Cl互为同位素,化学性质几乎完全相同,电子能力相同,故D正确,
故选D.
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.3517Cl与3717Cl互为同位素,化学性质几乎完全相同,电子能力相同,故D正确,
故选D.
点评:本题考查同主族元素性质递变规律、微粒半径比较、原子结构与性质关系等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
配制一定体积、一定物质的量浓度的溶液时,下列会使配得的溶液浓度偏低的是( )
| A、容量瓶中原有少量蒸馏水 |
| B、溶液从烧杯转移到容量瓶中后没有洗涤烧杯和玻璃棒 |
| C、定容时观察液面俯视 |
| D、定容时平视液面 |
下列说法正确的是( )
| A、2-丁烯不存在顺反异构体 |
| B、已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种 |
C、菲的结构简式为 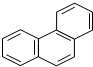 ,它与硝酸反应,可生成4种一硝基取代物 ,它与硝酸反应,可生成4种一硝基取代物 |
| D、乙醛的核磁共振氢谱中有二个峰,峰面积之比是1:3 |
某校化学兴趣小组的同学将等体积的甲烷与氯气混合于一集气瓶中,用玻璃片盖严后置于光亮处,一段时间后不可能观察到的现象是( )
| A、集气瓶中气体的黄绿色逐渐变浅 |
| B、集气瓶内壁上有油状液滴附着 |
| C、集气瓶底部出现黑色颗粒 |
| D、取下玻璃片,可能会看到白雾 |