题目内容
18.下列有关氧化还原反应的叙述正确的是( )| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中不一定所有元素的化合价都发生变化 | |
| C. | 金属单质在反应中只作还原剂,非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
分析 A、氧化还原反应中可能同种元素既被氧化又被还原;
B、氧化还原反应中一定存在元素的化合价变化,可能为同种元素,也可能为不同元素;
C、非金属单质也可作还原剂;
D.越易失电子还原性越强.
解答 解:A、反应2H2S+SO2═3S↓+2H2O中只有硫元素的化合价变化,故A错误;
B、反应2H2S+SO2═3S↓+2H2O中,H、O元素的化合价不变,则反应中不一定所有元素的化合价都发生变化,故B正确;
C、金属单质化合价只能升高,则在反应中只作还原剂,但非金属单质可升高可降低,例如S既有氧化性也具有还原性,故C错误;
D、越易失电子还原性越强,还原性强弱与失电子数多少无关,故D错误;
故选B.
点评 本题考查氧化还原反应及常见的化学反应,学生熟悉利用元素的化合价来分析性质,并能利用具体的化学反应来说明问题即可解答.

练习册系列答案
相关题目
13.向铁铜合金中加入过量的硝酸溶液,得到NO2、N2O4、NO混合气体,向反应后溶液中加入2mol/LNaOH溶液,至沉淀恰好完全.若将得到的NO2、N2O4、NO混合气体,与2.24L(标准状况下)O2混合后通入水中恰好被完全吸收生成硝酸.则反应中消耗的NaOH溶液的体积是( )
| A. | 150ml | B. | 180ml | C. | 200ml | D. | 250ml |
3.将amol/L Al2(SO4)3和钾离子浓度为2bmol/L的K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42-的浓度为( )
| A. | $\frac{(a+b)}{4}$ mol/L | B. | 4(3a+b) mol/L | C. | 4(a+b) mol/L | D. | $\frac{(3a+b)}{4}$mol/L |
1.下列有关金属的腐蚀及防护的说法不正确的是( )
| A. | 金属发生腐蚀的实质是:M-ne-=Mn+ | |
| B. | 金属发生的电化学腐蚀比化学腐蚀要普遍得多 | |
| C. | 防止金属生锈可以通过涂油漆、镀金属等方法在其表面覆盖一层保护膜 | |
| D. | 在钢铁上连接一个铜块可以防止钢铁生锈 |
2.反应 2x CO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2x CO2+N2 可用于处理汽车尾气,下列对该反应的说法中错误的是( )
| A. | NOx被还原 | B. | CO是还原剂 | ||
| C. | NOx反应中得到电子 | D. | CO发生还原反应 |
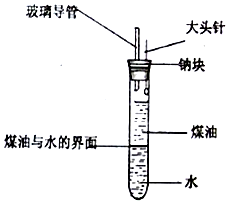 某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题: