题目内容
3.将amol/L Al2(SO4)3和钾离子浓度为2bmol/L的K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42-的浓度为( )| A. | $\frac{(a+b)}{4}$ mol/L | B. | 4(3a+b) mol/L | C. | 4(a+b) mol/L | D. | $\frac{(3a+b)}{4}$mol/L |
分析 先根据n=cV分别计算出硫酸铝、硫酸钾的物质的量,再计算出混合液中硫酸根离子的总物质的量,最后根据c=$\frac{n}{V}$计算出稀释后的溶液中SO42-的浓度.
解答 解:500mL a mol/L Al2(SO4)3中含有硫酸铝的物质的量为:amol/L×0.5L=0.5amol,
500mL钾离子浓度为2b mol/L的 K2SO4溶液中含有硫酸钾的物质的量为:2bmol/L×$\frac{1}{2}$×0.5L=0.5bmol,
混合液中含有硫酸根离子的总物质的量为:0.5amol×3+0.5bmol=1.5amol+0.5bmol,
稀释过程中硫酸根离子的物质的量不变,则稀释后的溶液中SO42-的浓度为:$\frac{1.5amol+0.5bmol}{2L}$=$\frac{3a+b}{4}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意溶液稀释过程中溶质的物质的量不变,试题培养了学生的化学计算能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
13.下列说法正确的是( )
| A. | 若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是104 | |
| B. | 用乙酰水杨酸  与适量NaOH溶液反应制备 与适量NaOH溶液反应制备  | |
| C. | 向柠檬醛 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. |  、 、 、 、 三种氨基酸脱水,最多可生成 6种二肽 三种氨基酸脱水,最多可生成 6种二肽 |
14.下列各组离子能在指定溶液中,大量共存的是( )
| A. | 含大量SO2的溶液中:NH4+、F-、HCO3-、ClO- | |
| B. | 能使淀粉碘化钾试纸变蓝的溶液:Cl-、Na+、S2-、NH4+ | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=10-13mol/L的溶液中:Al3+、Fe3+、NO3-、ClO4- | |
| D. | 滴入KSCN溶液显红色的溶液中:NO3+、Na+、AlO2-、K+ |
11.下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体.
①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体.
| A. | ①②③④⑤⑥ | B. | ①②⑤⑥ | C. | ①②③⑤ | D. | ①②③⑤⑥ |
18.下列有关氧化还原反应的叙述正确的是( )
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中不一定所有元素的化合价都发生变化 | |
| C. | 金属单质在反应中只作还原剂,非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
2.PCl5(g)一定条件下可以转化成PCl3(g)或红磷P(s).
(1)已知:
PCl5(g)═PCl3(g)+Cl2(g)△H1K1
PCl3(g)═P(s)+$\frac{3}{2}$Cl2(g)△H2K2
K1、K2表示该反应的平衡常数.
则PCl5(g)═P(s)+$\frac{5}{2}$Cl2(g)该反应的△H=△H1+△H2(用△H1、△H2表示),反应的平衡常数K=K1×K2(用K1、K2表示).
(2)在210℃时,将4mol PCl3气体充入1L真空恒容密闭容器中发生反应:2PCl3(g)═2P(s)+3Cl2(g)
测得数据如下表:
并测得反应达到平衡时热量变化数值为Q,反应平衡常数为K,PCl3转化率为α.
①0~30min时,用Cl2表示该反应的反应速率为0.15mol/(L.min);平衡时,PCl3转化率α=75%;该温度下反应的平衡常数K=91.125.
②其它条件保持不变,若上述反应在恒压条件下进行反应,达平衡时测得热量变化数值、平衡常数、PCl3转化率分别为Q′、K′、α′,则Q′>(填“>”“<”或“=”,下同)Q,K′=K,α′>α.
③保持其它条件不变,若向上述平衡体系中再充入1molCl2(g)、1molP(s)和1molPCl3(g),则上述平衡反应正向(填“正向”、“逆向”或“不”)移动.
(1)已知:
PCl5(g)═PCl3(g)+Cl2(g)△H1K1
PCl3(g)═P(s)+$\frac{3}{2}$Cl2(g)△H2K2
K1、K2表示该反应的平衡常数.
则PCl5(g)═P(s)+$\frac{5}{2}$Cl2(g)该反应的△H=△H1+△H2(用△H1、△H2表示),反应的平衡常数K=K1×K2(用K1、K2表示).
(2)在210℃时,将4mol PCl3气体充入1L真空恒容密闭容器中发生反应:2PCl3(g)═2P(s)+3Cl2(g)
测得数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
①0~30min时,用Cl2表示该反应的反应速率为0.15mol/(L.min);平衡时,PCl3转化率α=75%;该温度下反应的平衡常数K=91.125.
②其它条件保持不变,若上述反应在恒压条件下进行反应,达平衡时测得热量变化数值、平衡常数、PCl3转化率分别为Q′、K′、α′,则Q′>(填“>”“<”或“=”,下同)Q,K′=K,α′>α.
③保持其它条件不变,若向上述平衡体系中再充入1molCl2(g)、1molP(s)和1molPCl3(g),则上述平衡反应正向(填“正向”、“逆向”或“不”)移动.
9.二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由上述数据计算△H1=-99kJ/mol.
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-263kJ/mol,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(3)下列措施中,能提高CH3OCH3产率的有AD.
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡右移.
(5)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD.
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.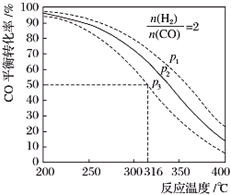
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ/mol | K3 |
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C≡O | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 1076 | 343 | 465 | 413 |
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-263kJ/mol,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示).
(3)下列措施中,能提高CH3OCH3产率的有AD.
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡右移.
(5)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD.
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.

6.反应NO+O2+NO2+H2O→HNO3(未配平),当氧化剂与还原剂的物质的量之比为1:3时,此反应各物质化学计量数(系数)之比为( )
| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |