题目内容
2.反应 2x CO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2x CO2+N2 可用于处理汽车尾气,下列对该反应的说法中错误的是( )| A. | NOx被还原 | B. | CO是还原剂 | ||
| C. | NOx反应中得到电子 | D. | CO发生还原反应 |
分析 2x CO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2x CO2+N2,C元素的化合价升高,N元素的化合价降低,结合氧化还原反应基本概念解答.
解答 解:A、NOx中N元素的化合价降低,被还原,故A正确;
B、C元素的化合价升高,CO为还原剂,故B正确;
C、NOx中N元素的化合价降低,得电子,故C正确;
D、C元素的化合价升高,CO为还原剂,发生氧化反应,故D错误;
故选D.
点评 本题考查氧化还原反应,把握氧化还原反应中元素的化合价变化为解答的关键,注意从化合价角度分析,侧重基本概念的考查,题目难度不大.

练习册系列答案
相关题目
18.下列有关氧化还原反应的叙述正确的是( )
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中不一定所有元素的化合价都发生变化 | |
| C. | 金属单质在反应中只作还原剂,非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
13.下列物质:钠、Br2、CO2、SO3、NH3、H2S、硫酸、醋酸、Ba(OH)2、NH3•H2O、氯化钠、硫酸钡、乙醇、盐酸、蔗糖、胆矾,属于电解质、非电解质、强电解质的分别有( )
| A. | 9种、7种、6种 | B. | 9种、5种、6种 | C. | 7种、5种、4种 | D. | 8种、5种、5种 |
10.下列说法正确的是( )
| A. | 铅蓄电池属于二次电池,在充电过程中,阳极质量减小,阴极质量增加 | |
| B. | 常温下,能自发进行的反应,△H一定小于“0” | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的活化能 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
17.天然气、石油、煤等在地球上的蕴藏量是有限的,下列说法正确的是( )
①可砍伐树木、野草作能源
②可用酒精作能源
③可利用电解水的方法制得氢气作能源
④应开发太阳能、核能等新能源
⑤大量应用风能、水能等可再生能源.
①可砍伐树木、野草作能源
②可用酒精作能源
③可利用电解水的方法制得氢气作能源
④应开发太阳能、核能等新能源
⑤大量应用风能、水能等可再生能源.
| A. | ① | B. | ①⑤ | C. | ②③ | D. | ②④⑤ |
14.在强酸性的透明溶液中,下列离子组能够大量共存是( )
| A. | Na+、K+、OH-、Cl- | B. | Mg2+、Cu+、SO42-、Cl- | ||
| C. | K+、Ba2+、Cl-、HCO3- | D. | NH4+、Ba2+、Fe3+、SO42- |
12.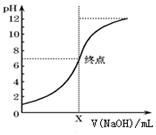 某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有ADF.
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为10
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH=1+lg3,(含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是D
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定--取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
①滴定时,滴定终点时滴定现象是锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色
②该草酸溶液的物质的量浓度为0.2 mol/L.
 某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有ADF.
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为10
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH=1+lg3,(含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是D
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定--取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
| 数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 23.40 |
| 第二次 | 25.00 | 4.00 | 23.90 |
| 第三次 | 25.00 | 5.00 | 25.10 |
②该草酸溶液的物质的量浓度为0.2 mol/L.