题目内容
14.配制250mL0.10mol•L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大是( )| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | NaOH固体溶解后立即转入容量瓶 | |
| C. | 在容量瓶中进行定容时仰视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
分析 根据c=$\frac{n}{V}$,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
解答 解:A、未洗涤溶解NaOH的烧杯,会导致溶质的损失,则溶液浓度偏小,故A不选;
B、NaOH固体溶解放热,未经冷却立即转入容量瓶当冷却至室温后溶液体积偏小,所配溶液浓度偏大,故选B;
C、定容时仰视刻度线,会导致溶液体积偏大,溶液浓度偏小,故C不选;
D、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线是正常的,再加水至刻度线会导致浓度偏小,故D不选.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
19.常温下用0.1000mol•L-1Na0H溶液滴定20.00mol某未知浓度的醋酸溶液,滴定曲线如图.
已知①点所示溶液中c(CH3COO-)=2c(CH3C00H),
③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应.
下列说法不正确的是( )
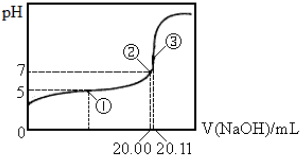
已知①点所示溶液中c(CH3COO-)=2c(CH3C00H),
③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应.
下列说法不正确的是( )

| A. | 该温度下CH3COOH的电离平衡常数Ka=2.0×10-5 | |
| B. | ③点所示溶液中:c(CH3C00-)+c(CH3C00H)=(Na+)+c(0H-) | |
| C. | 该醋酸的浓度为0.1006mol•L-1 | |
| D. | 由图示可以计算醋酸钠的水解平衡常数为5.0×10-10 |
20.复分解反应中有一规律:强酸与弱酸盐反应可以生成弱酸(如2HCl+CaCO3=CaCl2+H2O+CO2↑);在常温下,测得下列酸溶液(浓度均为a%)酸性强弱顺序:H2SO4>HCl>H2S>H2CO3>HClO;下列反应均能发生,其中不符合该规律的是( )
| A. | H2SO4+2NaHCO3═2NaCl+2H2O+2CO2↑ | B. | 2HCl+BaS═BaCl2+H2S↑ | ||
| C. | CO2+H2O+Ca(ClO)2═CaCO3↓+2HClO | D. | H2S+CuSO4═CuS↓+H2SO4 |
3.如今人们把食品分为绿色食品、蓝色食品、白色食品等类型.绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品.下面属于白色食品的是( )
| A. | 海带 | B. | 食盐 | C. | 面粉 | D. | 酸奶 |
4.下列装置或操作能达到实验目的是( )
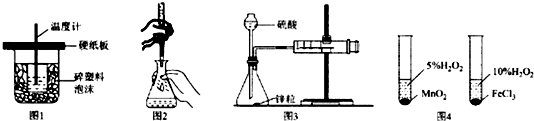

| A. | 图1装置用于中和热的测定 | |
| B. | 图2装置用于高锰酸钾溶液滴定草酸 | |
| C. | 图3装置用于测定氢气的反应速率(单位mL/s) | |
| D. | 图4装置用于研究不同催化剂对反应速率的影响 |