题目内容
19.常温下用0.1000mol•L-1Na0H溶液滴定20.00mol某未知浓度的醋酸溶液,滴定曲线如图.已知①点所示溶液中c(CH3COO-)=2c(CH3C00H),
③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应.
下列说法不正确的是( )
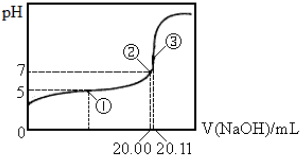
| A. | 该温度下CH3COOH的电离平衡常数Ka=2.0×10-5 | |
| B. | ③点所示溶液中:c(CH3C00-)+c(CH3C00H)=(Na+)+c(0H-) | |
| C. | 该醋酸的浓度为0.1006mol•L-1 | |
| D. | 由图示可以计算醋酸钠的水解平衡常数为5.0×10-10 |
分析 A.①为缓冲溶液,pH=pKa-lg$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,据此计算电离平衡常数;
B.③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应生成醋酸钠,根据物料守恒得c(CH3C00-)+c(CH3C00H)=(Na+);
C.在点③处恰好中和,反应生成醋酸钠,根据质子守恒可得:c(OH-)=c(CH3COOH)+c(H+),原溶液中醋酸的浓度为:$\frac{0.1000mol/L×0.02011L}{0.02L}$=0.1006mol/L;
D.电离平衡常数、水解平衡常数与离子积常数关系为Ka.Kh=Kw.
解答 解:A.①为缓冲溶液,pH=pKa-$\frac{lgc(C{H}_{3}CO{O}^{-})}{lgc(C{H}_{3}COOH)}$,pKa=pH+lg$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=5+lg$\frac{1}{2}$=5-lg2,Ka=2×10-5,故A正确;
B.③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应生成醋酸钠,根据物料守恒得c(CH3C00-)+c(CH3C00H)=(Na+),所以c(CH3C00-)+c(CH3C00H)>(Na+)+c(0H-),故B错误;
C.在点③处恰好中和,反应生成醋酸钠,根据质子守恒可得:c(OH-)=c(CH3COOH)+c(H+),原溶液中醋酸的浓度为:$\frac{0.1000mol/L×0.02011L}{0.02L}$=0.1006mol/L,故C正确;
D.电离平衡常数、水解平衡常数与离子积常数关系为Ka.Kh=Kw,所以Kh=$\frac{1{0}^{-14}}{2×1{0}^{-5}}$=5.0×10-10,
故D正确;
故选B.
点评 本题以酸碱混合溶液定性判断为载体考查图象分析,为高频考点,明确图中曲线每一点溶质成分及其性质是解本题关键,侧重考查学生分析计算能力,注意公式Ka.Kh=Kw及缓冲溶液中弱电解质电离平衡常数的计算方法,题目难度中等.

| A. | NO与O2在反应生成NO2 | B. | 硝酸工厂用NH3氧化制NO | ||
| C. | 雷雨时空气中的N2转化为NO | D. | 由NH3制碳酸氢铵和硫酸铵 |
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1 mol/L Na2C2O4与0.1 mol/L HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
| A. | 标准状况下1mol的水所占的体积约为22.4L | |
| B. | 标准状况下2g H2所占的体积约为22.4L | |
| C. | 常温常压下1mol的水所占的体积约为22.4L | |
| D. | 常温常压下2g H2所占的体积约为22.4L |
| A. | CaSiO3固体 | B. | SiO2 | C. | Na2SiO3水溶液 | D. | H2SiO3 |
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | NaOH固体溶解后立即转入容量瓶 | |
| C. | 在容量瓶中进行定容时仰视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
 PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、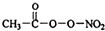 (PAN)等二次污染物.
(PAN)等二次污染物.