题目内容
7. 硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.(1)基态锌原子的价电子排布式是3d104s2.
(2)根据元素周期律,电负性Se<S,第一电离能Se<As(填“>”或“<”)
(3)H2Se的分子构型是V形,其中Se的杂化轨道类型是sp3.
(4)H2O的沸点(100℃)高于H2Se的沸点(-42℃)其原因是H2O含有氢键、H2Se不含氢键.
(5)晶体Zn为六方最密堆积,其配位数是12.
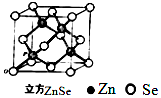
(6)ZnSe晶胞如图,假设阿伏伽德罗常数值为NA,则144gZnSe晶体中的晶胞数是$\frac{{N}_{A}}{4}$.
分析 (1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子;
(2)同一主族元素,元素电负性随着原子序数增大而减小;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式;
(4)含有氢键的氢化物熔沸点较高;
(5)晶体中Zn原子的配位数为12;
(6)该晶胞中Zn原子个数为4、Se原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞质量=$\frac{79+65}{{N}_{A}}×4$,根据晶体质量与晶胞质量确定晶胞个数.
解答 解:(1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子,其价电子排布式为3d104s2,故答案为:3d104s2;
(2)同一主族元素,元素电负性随着原子序数增大而减小,所以电负性Se<S;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能Se<Sn,
故答案为:<;<;
(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式分别为V形、sp3,
故答案为:V形;sp3;
(4)含有氢键的氢化物熔沸点较高,H2O含有氢键、H2Se不含氢键,导致H2O的沸点(100℃)高于H2Se的沸点(-42℃),故答案为:H2O含有氢键、H2Se不含氢键;
(5)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图 可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,故答案为:12;
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,故答案为:12;
(6)该晶胞中Zn原子个数为4、Se原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞质量=( $\frac{79+65}{{N}_{A}}×4$)g,晶胞个数=$\frac{144g}{(\frac{79+65}{{N}_{A}}×4)g}$=$\frac{{N}_{A}}{4}$,
故答案为:$\frac{{N}_{A}}{4}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、氢键、元素周期律等知识点,侧重考查学生分析、判断、计算及空间想象能力,难点是晶胞计算及配位数计算,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 能全部透过半透膜 | B. | 没有丁达尔现象 | ||
| C. | 所得液体透过滤纸 | D. | 所得物质一定是浊液 |
| A. | 可用KI鉴别淀粉溶液和Na2CO3溶液 | |
| B. | 隔夜蔬菜中的部分硝酸盐被氧化为有毒的亚硝酸盐 | |
| C. | 沾附水滴的铁质餐具生锈是化学腐蚀所致 | |
| D. | 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
| A. | 向蒸馏水中加入Na2O,水的电离程度变小 | |
| B. | 向0.1mol•L-1的醋酸溶液中加水稀释后溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 向0.1mol•L-1的醋酸溶液中加水稀释后溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$不变 | |
| D. | 向0.1mol•L-1的醋酸溶液稀释到原体积的10倍后,溶液的PH=2 |
| 选项 | A | B | C | D |
| 实验过程 |  |  |  |  |
| 实验目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯化铁溶液呈酸性,可用氯化铁溶液蚀刻铜电路板 | |
| B. | 铝的金属性比钒强,可用铝与五氧化二钒反应制取金属钒 | |
| C. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| D. | 二氧化硫具有漂白性,能使溴水褪色 |
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.(1)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体.
2xCO+2NOx═2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积2.24L.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$.
②取一定体积CO和H2的混合气体(物质的量之比为1:2),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H<0 (填“>”、“<”或“=”).
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”、“<”或“=”).
④若容器容积不变,下列措施可增加甲醇产率的是BD
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤经测定不同温度下该反应的平衡常数如表:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为O2+4e-=2O2-.电池工作时,固体电解质里的O2-向负极移动.

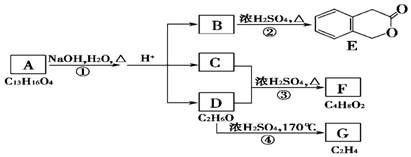
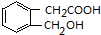
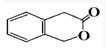 +H2O(有机物须用结构简式表示)
+H2O(有机物须用结构简式表示)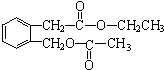 ;反应④的反应类型是消去反应.
;反应④的反应类型是消去反应. .
.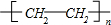 .
.