题目内容
17.“纳米材料”是当今材料科学研究的前沿,其研究成果广泛用于催化剂及军事科学中.所谓“纳米材料”是指研究、开发出的直径从几纳米到几十纳米的材料.如将纳米材料分散到分散剂中,所得混合物可能具有的性质是(1nm=10-9m)( )| A. | 能全部透过半透膜 | B. | 没有丁达尔现象 | ||
| C. | 所得液体透过滤纸 | D. | 所得物质一定是浊液 |
分析 由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,以此来解答.
解答 解:分散系中分散质的直径在1nm~100nm之间的属于胶体分散系,
由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,则该混合物属于胶体.
A.胶粒能透过滤纸,不能透过半透膜,故A错误;
B.胶体具有丁达尔现象,故B错误;
C.胶体可能呈胶状,故C正确;
D.该混合物属于胶体,不属于悬浊液或乳浊液,故D错误;
故选C.
点评 本题考查分散系的判断及胶体的性质,明确纳米材料的直径是解答本题的关键,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
7.设NA为阿佛加德罗常数,下列说法正确的是( )
| A. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| B. | 1L 2 mol•L-1的AlCl3溶液中含Al3+数为2NA | |
| C. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| D. | 室温下,8g甲烷含有共价键数为2NA |
8.下列解释实验事实的离子方程式正确的是( )
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
5.钠与水反应时的现象中与钠的下列性质无关的是( )
| A. | 钠的熔点低 | B. | 钠的密度小 | C. | 钠的硬度小 | D. | 有强还原性 |
12. 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
(1)该图中有两处仪器未画出,它们是泡沫塑料板(硬纸板)、环形玻璃搅拌棒.
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm2,中和后生成溶液的比热容c=4.08J/(g•℃).则中和热△H=-52.2kJ/mol(取小数点后一位).
(4)有关中和热测定实验,下列说法错误的是bc
a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:(1)该图中有两处仪器未画出,它们是泡沫塑料板(硬纸板)、环形玻璃搅拌棒.
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
(4)有关中和热测定实验,下列说法错误的是bc
a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
2.用锌,氧化铜,稀硫酸作原料制取铜时,有下列两种途径:
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
9.下列与化学概念有关的说法正确的是( )
| A. | 化合反应均为氧化还原反应 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| D. | 摩尔是七个基本物理量之一 |
6.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述正确的是( )
| A. | 电池放电时正极上有气泡产生 | B. | 电池放电时Cl-由负极向正极迁移 | ||
| C. | 正极反应式为Ag++e-=Ag | D. | 负极副反应为Mg+H2O=Mg(OH)2+H2↑ |
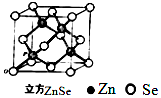 硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.