题目内容
7. 常温下,pH=11的X、Y两种碱溶液各10mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=11的X、Y两种碱溶液各10mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | X、Y两种碱溶液中溶质的物质的量浓度一定相等 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性强 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积V(X)<V(Y) | |
| D. | 若a=10,则X、Y都是弱碱 |
分析 常温下,将pH=11的X、Y两种碱溶液各10mL,分别稀释至100mL,加水稀释促进弱电解质电离,导致稀释后溶液中c(OH-)大于原来$\frac{1}{10}$,所以稀释过程中碱越弱,溶液pH变化越小,根据图知,碱性X>Y,
A.碱性不同,导致pH相同的不同碱其物质的量浓度不同;
B.相同温度下pH越大碱性越强;
C.pH=11的X、Y两种碱,c(X)<c(Y),相同体积、相同pH的X、Y用相同浓度的盐酸中和时,碱的物质的量越大消耗酸体积越大;
D.若a=10,X溶液体积增大一倍,(OH-)为原来$\frac{1}{10}$,说明X为强碱,Y溶液中,(OH-)大于原来$\frac{1}{10}$,说明为弱碱.
解答 解:常温下,将pH=11的X、Y两种碱溶液各10mL,分别稀释至100mL,加水稀释促进弱电解质电离,导致稀释后溶液中c(OH-)大于原来$\frac{1}{10}$,所以稀释过程中碱越弱,溶液pH变化越小,根据图知,碱性X>Y,
A.碱性不同,导致pH相同的不同碱其物质的量浓度不同,根据图知,X、Y碱性不同,所以相同pH的X、Y其物质的量浓度不等,且c(X)<c(Y),故A错误;
B.相同温度下pH越大溶液的碱性越强,根据图知,pH Y>X,所以稀释后碱性Y>X,故B错误;
C.pH=11的X、Y两种碱,c(X)<c(Y),相同体积、相同pH的X、Y,n(Y)>n(X),用相同浓度的盐酸中和时,碱的物质的量越大消耗酸体积越大,所以消耗相同浓度盐酸V(X)<V(Y),故C正确;
D.若a=10,X溶液体积增大一倍,(OH-)为原来$\frac{1}{10}$,说明X为强碱,Y溶液中,(OH-)大于原来$\frac{1}{10}$,说明为弱碱,则X是强碱、Y是弱碱,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,正确判断碱性强弱是解本题关键,要根据稀释前后pH变化相对大小判断溶液碱性强弱,易错选项是C.

| A. | 糖类物质都有甜味 | B. | 糖类物质的组成都符合通式Cm(H2O)n | ||
| C. | 动植物的生命活动都需要糖 | D. | 糖类都能发生水解反应 |
| 实验编号 | HCl的物质的量浓度 (mol•L-1) | BOH的物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
(1)从第①组情况分析,BOH是弱碱(选填“强碱”或“弱碱”).该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1.
(2)第②组情况表明,c<0.2.该混合液中离子浓度c(B+)=c(Cl-)(选填“<”、“>”或“=”).
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度>BCl的水解程度
乙:混合溶液中的离子浓度由大到小的顺序c(B+)>c(Cl-)>c(OH-)>c(H+).
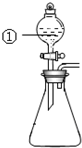 用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是( )| 选项 | ①中物质 | 锥形瓶中物质 | 预测锥形瓶中的现象 |
| A | 浓盐酸 | “84”消毒液 | 有黄绿色气体产生 |
| B | 浓硝酸 | 光洁的铁钉 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 先有白色沉淀生成, 后沉淀又溶解 |
| D | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色, 有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH3C(CH3)═CH-CH3+Br2(aq) | B. | CH2═CHCH2CH3+HCl(催化剂) | ||
| C. | CH3CH═CH2+H2O(催化剂) | D. | nCH3CH═CH2(催化剂) |
| A. | 2,3二溴丙烯 | B. | 2,3二甲基-2-丁烯 | ||
| C. | 丙烯 | D. | 2-丁烯 |
| A. | 盐酸 | B. | 酸性高锰酸钾 | C. | 溴水 | D. | 石蕊试液 |