题目内容
19.能用铝槽车运输的是( )| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 氢氧化钠溶液 |
分析 常温下和金属铝之间不会发生反应或是可以产生钝化现象的物质能用铝槽车运输.
解答 解:A.常温下,金属铝和浓硫酸之间发生钝化,在铝的表面形成致密的氧化膜,能保护内部金属不被反应,所以能用铝槽车运输,故A正确;
B.吸硝酸和金属铝在常温下可以发生反应,所以不能用铝槽车运输,故B错误;
C.盐酸和金属铝在常温下可以发生反应,所以不能用铝槽车运输,故C错误;
D.氢氧化钠溶液和金属铝在常温下可以发生反应,所以不能用铝槽车运输,故D错误.
故选A.
点评 本题考查了金属铝的化学性质,注意知识的归纳和梳理是关键,注意常温下铝、铁遇到浓硫酸和浓硝酸会钝化,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
9.X、Y为短周期元素,X的最高价氧化物对应的水化物是难溶碱.Y元素的原子次外层电子数为2;它的最高价氧化物对应的水化物为强酸;X的单质在Y中燃烧生成的化合物的电子数为( )
| A. | 19 | B. | 30 | C. | 45 | D. | 50 |
11.下列选项中所涉及到的两个量一定不相等的是( )
| A. | 足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数 | |
| B. | 等物质的量的KO2与CaO2分别与水反应生成O2的体积(相同条件下) | |
| C. | 100mL 1mol/L HNO3分别与1.4g Fe、2.8gFe完全反应时生成 的NO物质的量 | |
| D. | 等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量气体时转移的电子数 |
8.为了消除氮的氧化物(NOx)对大气的污染,工业上通常利用反应NOx+NH3→N2+H2O来保护环境,现有NO2和NO的混合气体3L,可用3.5L NH3恰好使其完全转化为N2,则混和气体中NO2和NO的气体体积之比为( )
| A. | 1:4 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
9.已知26%氨水的密度约为0.91g•cm-3,6%氨水的密度约为0.98g•cm-3若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )
| A. | 等于16% | B. | 大于16% | C. | 小于16% | D. | 无法估算 |
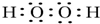 .W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答) ;含极性共价键的分子的中心原子轨道杂化类型sp;
;含极性共价键的分子的中心原子轨道杂化类型sp;