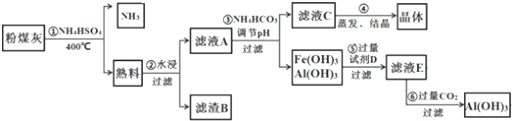
题目内容
4.混合物A由碳酸钠和碳酸氢钠组成.现有两包质量相等的混合物A:(1)若向其中一包加入50ml3mol/L的Ba(OH)2溶液(过量),使CO32-、HCO3-全部变为沉淀,过滤后,再向滤液中加入50mL2mol/L的稀硫酸,溶液恰好呈中性.
①写出下列反应的离子方程式
碳酸钠与氢氧化钡的反应:CO32-+Ba2+=BaCO3↓;碳酸氢钠与过量氢氧化钡的反应:HCO3-+Ba2++OH-=BaCO3↓+H2O;
②混合物A中NaHCO3的质量为16.8g.
(2)若向另一包中先加50mL8mol/L的HCl溶液,使CO32-、HCO3-全部变为CO2后,再加50mL2mol/L的
Ba(OH)2溶液,混合后的溶液pH=14.(混合后溶液体积变化忽略不计)
①写出有关的离子方程式CO32-+2H+=CO2↑+H2O,HCO3-+H+=CO2↑+H2O;
②混合物A中Na2CO3的质量为5.3g.
分析 (1)①碳酸钠与氢氧化钡反应生成碳酸钡沉淀;碳酸氢钠与过量氢氧化钡的反应生成碳酸钡沉淀和氢氧化钠;HCO3-+Ba2++OH-=BaCO3↓+H2O;
②碳酸根、碳酸氢根全部沉淀,与盐酸反应的只是剩余的OH-,根据盐酸的物质的量可以求出剩余的n(OH-),氢氧化钡电离的OH-有0.3mol,则可以求出与HCO3-反应的OH-进而求出OH-,即求出NaHCO3;
(2)①向碳酸钠和碳酸氢钠中HCl溶液反应生成氯化钠和二氧化碳、水;
②设碳酸钠的物质的量为x,则剩余HCl为:0.4mol-0.2mol-2x=0.2mol-2x,
氢氧化钡电离的OH-为0.2mol,由混合后的溶液pH=14知与氢氧化钡反应后剩余OH-为0.1mol,
则0.2mol-2x=0.2mol-0.1mol x=0.05mol,然后求出碳酸钠的质量.
解答 解:(1)①碳酸钠与氢氧化钡反应生成碳酸钡沉淀,其反应的离子方程式为:CO32-+Ba2+=BaCO3↓;碳酸氢钠与过量氢氧化钡的反应生成碳酸钡沉淀和氢氧化钠,其反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
故答案为:CO32-+Ba2+=BaCO3↓;HCO3-+Ba2++OH-=BaCO3↓+H2O;
②碳酸根、碳酸氢根全部沉淀,与盐酸反应的只是剩余的OH-,已知盐酸的物质的量为0.05L×2mol/L=0.1mol,则与HCO3-反应后剩余的n(OH-)=0.1mol,氢氧化钡电离的OH-有005L×3mol/L×2=0.3mol,所以与HCO3-反应的OH-为0.2mol,由HCO3-+Ba2++OH-=BaCO3↓+H2O可知,NaHCO3为0.2mol,所以NaHCO3的质量为0.2mol×84g/mol=16.8g;
故答案为:16.8g;
(2)①向碳酸钠和碳酸氢钠中HCl溶液反应生成氯化钠和二氧化碳、水,反应的离子方程式分别为:CO32-+2H+=CO2↑+H2O;HCO3-+H+=CO2↑+H2O;
故答案为:CO32-+2H+=CO2↑+H2O;HCO3-+H+=CO2↑+H2O;
②设碳酸钠的物质的量为x,与碳酸钠反应的盐酸为2xmol,与碳酸氢钠反应的盐酸为0.2mol;
则剩余HCl为:0.4mol-0.2mol-2x=0.2mol-2x,
氢氧化钡中OH-为0.05L×2mol/L×2=0.2mol,由混合后的溶液pH=14知与氢氧化钡反应后剩余OH-为0.1mol,
则与盐酸的反应的氢氧根离子为0.1mol,则0.2mol-2x=0.1mol,所以x=0.05mol,则碳酸钠的质量为 0.05mol×106g/mol=5.3g;
故答案为:5.3.
点评 本题考查了有关离子方程式的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握混合物与酸碱反应的方程式.

| A. | 将FeCl3固体放入水中搅拌 | |
| B. | 向FeCl3溶液中加入NaOH溶液 | |
| C. | 加热FeCl3溶液 | |
| D. | 向沸水中滴加饱和FeCl3溶液,并加热至红褐色 |
| A. |  | B. |  | C. |  | D. |  |
| A. | K+ Na+SO42- Cl- | B. | Cu2+ Al3+ Cl-SO42- | ||
| C. | Fe2+NO3-Cl-CO32- | D. | Ag+ Na+NO3- Cl- |
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 氢氧化钠溶液 |
| A. | 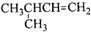 命名为3-甲基丁烯 命名为3-甲基丁烯 | |
| B. | CH3-O-CH3分子在核磁共振氢谱图中只能给出一种信号 | |
| C. | (CH3)3CCH2Cl不能发生消去反应 | |
| D. | 二氟二氯甲烷(CCl2F2)是分子是平面结构 |
| A. | 8mol | B. | 17mol | C. | 0.5mol | D. | 1mol |