题目内容
8.P、Q、W、X、Y、Z 是元素周期表前36 号元素中的六种常见元素,其原子序数依次增大.W 原子外层电子数与核外电子总数之比是3:4,P 可与W 形成两种常见的化合物M 和N,其分子中原子个数比分别为2:1 和1:1,Q、Y 的氧化物是导致酸雨的主要物质,X 是地壳中含量高的金属元素,Z 能形成红色(或砖红色)的Z2O 和黑色的ZO 两种氧化物.(1)N 的电子式为:
 .W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y 的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)(2)XQ 是一种新型的结构陶瓷材料,具备许多优良的性能,合成的方法之一是高温时用过量的碳在Q 单质气体的氛围中还原X 的氧化物,试写出该反应的化学反应方程式:N2+Al2O3+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(3)已知常温时NaPYW3的溶液溶液呈现较强的酸性,则其溶液中各离子浓度由大到小的排列顺序为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
(4)Q 的氢化物与Y 的高价氧化物对应的水化物反应生成一种正盐,其水溶液呈酸性,原因是NH4++H2O?NH3•H2O+H+(离子方程式解释).
(5)ZCl2溶液中混有FeCl3杂质时,可加入Cu(填试剂化学式)调节pH=4,再过滤.[Fe(OH)3的Ksp=10-35,化学式认为残留在溶液中的离子浓度小于10-5mol/L 时沉淀就达完全]
(6)工业上可用高温条件下O2+Z2Y═2Z+YO2来冶炼金属Z,生成1molZ 时转移的电子总数为3NA.
分析 P、Q、W、X、Y、Z 是元素周期表前36 号元素中的六种常见元素,其原子序数依次增大.W 原子外层电子数与核外电子总数之比是3:4,最外层电子数不超过8个,则其最外层电子数为6、核外电子数为8,为O元素;
P 可与W 形成两种常见的化合物M 和N,其分子中原子个数比分别为2:1 和1:1,则P为H元素;
Q、Y 的氧化物是导致酸雨的主要物质,且Q原子序数小于Y,则Q是N元素、Y是S元素;
X 是地壳中含量高的金属元素,则X为Al元素;
Z 能形成红色(或砖红色)的Z2O 和黑色的ZO 两种氧化物,则Z是Cu元素;
结合题目分析解答.
解答 解:P、Q、W、X、Y、Z 是元素周期表前36 号元素中的六种常见元素,其原子序数依次增大.W 原子外层电子数与核外电子总数之比是3:4,最外层电子数不超过8个,则其最外层电子数为6、核外电子数为8,为O元素;
P 可与W 形成两种常见的化合物M 和N,其分子中原子个数比分别为2:1 和1:1,则P为H元素;
Q、Y 的氧化物是导致酸雨的主要物质,且Q原子序数小于Y,则Q是N元素、Y是S元素;
X 是地壳中含量高的金属元素,则X为Al元素;
Z 能形成红色(或砖红色)的Z2O 和黑色的ZO 两种氧化物,则Z是Cu元素;
(1)N为HO2O2,电子式为: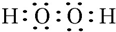 ,W、X、Y的离子分别为O2-、Al3+、S2-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序为:S2->O2->Al3+,
,W、X、Y的离子分别为O2-、Al3+、S2-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序为:S2->O2->Al3+,
故答案为: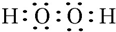 ;S2->O2->Al3+;
;S2->O2->Al3+;
(2)高温时用过量的碳在氮气的氛围中还原Al2O3得到AlN,反应还生成CO,该反应的化学反应方程式:N2+Al2O3+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,
故答案为:N2+Al2O3+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;
(3)常温时NaHSO3的溶液溶液呈现较强的酸性,溶液中c(H+)>c(OH-),说明HSO3-的电离程度大于其水解程度,溶液中氢离子源于水与的HSO3-电离,故溶液中(H+)>c(SO32-),电离与水解程度都不大,故溶液中钠离子浓度增大,溶液中c(HSO3-)>c(H+),酸性条件下水的电离很微弱,故溶液中c(SO32-)>c(OH-),则溶液中各离子浓度由大到小的排列顺序为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(4)Q的氢化物为NH3,Y的最高价氧化物对应的水化物为H2SO4,反应生成一种正盐为(NH4)2SO4,其水溶液中存在:NH4++H2O?NH3•H2O+H+,呈酸性,
故答案为:酸;NH4++H2O?NH3•H2O+H+;
(5)CuCl2溶液中混有FeCl3杂质时,可加入CuO等调节pH,再过滤除去,溶液中的离子浓度小于10-5mol/L时沉淀就达完全,由10-35=c(Fe3+)×c3(OH-),可知c(OH-)=10-10mol/L,故溶液pH=-lg$\frac{1{0}^{-14}}{1{0}^{-10}}$=4,应调节pH=4,
故答案为:CuO;4;
(6)工业上可用高温条件下O2+Cu2S═2Cu+SO2来冶炼金属Cu,反应中只有S元素化合价升高,由-2价升高为+4价,生成1molCu时得到二氧化硫为0.5mol,转移的电子总数为0.5mol×6=3mol,则转移电子数为3NA,
故答案为:3NA.
点评 本题考查位置结构相互关系及应用,为高频考点,涉及氧化还原反应、除杂、盐类水解、元素周期律等知识点,综合性较强,明确基本原理、原子及物质结构和性质是解本题关键,难点是(5)题有关计算,题目难度中等.

| A. | 刻度线 | B. | 使用温度 | C. | 规格 | D. | 0刻度 |
| A. | 钠在自然界中不存在游离态 | B. | 钠是一种白色固体 | ||
| C. | 钠可以保存在煤油中 | D. | 钠着火时可以用水灭火 |
 某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:
某种由Al与Al2O3粉末组成的混合物样品,利用如下图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如下表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
(2)求样品中Al的质量分数.(要求有计算过程)
| A. | 将FeCl3固体放入水中搅拌 | |
| B. | 向FeCl3溶液中加入NaOH溶液 | |
| C. | 加热FeCl3溶液 | |
| D. | 向沸水中滴加饱和FeCl3溶液,并加热至红褐色 |
| A. | 铁作负极 | |
| B. | 正极材料可以是石墨 | |
| C. | 电解质可以是CuSO4溶液 | |
| D. | 0.2mol电子通过电解质移动向正极被0.2molCu2+得到 |
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 氢氧化钠溶液 |