题目内容
7.黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S═K2S+N2↑+3CO2↑(已配平)(1)除S外,上列元素的第一电离能从大到小依次为N>O>C>K;
(2)生成物中,K2S的电子式为
 ;含极性共价键的分子的中心原子轨道杂化类型sp;
;含极性共价键的分子的中心原子轨道杂化类型sp;(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为1:1
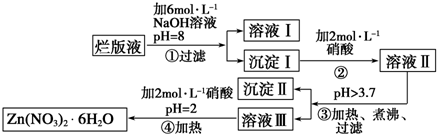
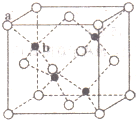
(4)S的基态原子价层电子排布式为3s23p4,S的一种化合物ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如下图所示,其晶胞边长为540.0pm,密度为4.1g•cm3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为$\frac{270}{\sqrt{1-cos109°28′}}$pm.
分析 (1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减小;
(2)K2S中钾离子和硫离子之间存在离子键,为离子化合物;生成物中含有极性共价键的分子是二氧化碳分子,该分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断C原子杂化类型;(3)CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
(4)S原子3s、3p电子为其价电子,根据构造原理书写S原子价电子排布式;该晶体中S2-个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Zn2+个数=4,该晶胞中a、b离子个数之比=4:4=1:1,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$;
每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270$\sqrt{2}$pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270$\sqrt{2}$)2,据此计算x.
解答 解:(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,元素第一电离能随着原子序数增大而减小,所以这几种元素第一电离能大小顺序是N>O>C>K,
故答案为:N>O>C>K;
(2)K2S中钾离子和硫离子之间存在离子键,为离子化合物,电子式为 ;生成物中含有极性共价键的分子是二氧化碳分子,该分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断C原子杂化类型为sp,
;生成物中含有极性共价键的分子是二氧化碳分子,该分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断C原子杂化类型为sp,
故答案为: ; sp;
; sp;
(3)CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为2:2=1:1,
故答案为:1:1;
(4)S原子3s、3p电子为其价电子,根据构造原理书写S原子价电子排布式为3s23p4;该晶体中S2-个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Zn2+个数=4,该晶胞中a、b离子个数之比=4:4=1:1,
该晶胞的边长为540.0pm=5.4×10-8cm,则体积为1.57×10-22cm3,该物质的密度$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{(65+32)×4}{{N}_{A}}}{1.57×1{0}^{-22}}$g/cm3=4.1g/cm3;
每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270$\sqrt{2}$pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270$\sqrt{2}$)2,x=$\sqrt{\frac{(270\sqrt{2})^{2}}{2(1-cos109°28′)}}$pm=$\frac{270}{\sqrt{1-cos109°28′}}$pm,
故答案为:3s23p4;4.1;$\frac{270}{\sqrt{1-cos109°28′}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、电子式的书写、原子核外电子排布、原子杂化类型判断等知识点,侧重考查学生分析计算及知识综合运用能力,难点是晶胞计算,题目难度中等.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 钠在自然界中不存在游离态 | B. | 钠是一种白色固体 | ||
| C. | 钠可以保存在煤油中 | D. | 钠着火时可以用水灭火 |
| A. | 铁作负极 | |
| B. | 正极材料可以是石墨 | |
| C. | 电解质可以是CuSO4溶液 | |
| D. | 0.2mol电子通过电解质移动向正极被0.2molCu2+得到 |
| A. |  | B. |  | C. |  | D. |  |
| A. | K+ Na+SO42- Cl- | B. | Cu2+ Al3+ Cl-SO42- | ||
| C. | Fe2+NO3-Cl-CO32- | D. | Ag+ Na+NO3- Cl- |
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 氢氧化钠溶液 |
| A. | (NH4)2SO4溶液能使蛋白质变性 | |
| B. | 分子式为C2H4O2的有机物不一定是羧酸 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 纤维素、蛋白质、油脂、葡萄糖在一定条件下都能发生水解反应 |