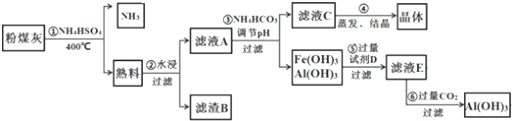
题目内容
8.为了消除氮的氧化物(NOx)对大气的污染,工业上通常利用反应NOx+NH3→N2+H2O来保护环境,现有NO2和NO的混合气体3L,可用3.5L NH3恰好使其完全转化为N2,则混和气体中NO2和NO的气体体积之比为( )| A. | 1:4 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
分析 相同条件下气体的体积比等于物质的量比,设NO2和NO的体积分别为x、y,
由体积及电子守恒可知,
$\left\{\begin{array}{l}{x+y=3}\\{4x+2y=3.5×3}\end{array}\right.$,以此来解答.
解答 解:相同条件下气体的体积比等于物质的量比,设NO2和NO的体积分别为x、y,
由体积及电子守恒可知,
$\left\{\begin{array}{l}{x+y=3}\\{4x+2y=3.5×3}\end{array}\right.$,
解得x=2.25,y=0.75,
则混和气体中NO2和NO的气体体积之比为2.25:0.75=3:1,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握物质的量与体积的关系、电子守恒等为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
17.已知在一容器中用原电池实现反应:Fe+Cu2+═Fe2++Cu,有关说法不正确的是( )
| A. | 铁作负极 | |
| B. | 正极材料可以是石墨 | |
| C. | 电解质可以是CuSO4溶液 | |
| D. | 0.2mol电子通过电解质移动向正极被0.2molCu2+得到 |
19.能用铝槽车运输的是( )
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 氢氧化钠溶液 |
3.已知a、b两种脂肪烃的结构简式如图所示.下列说法中不正确的是( )
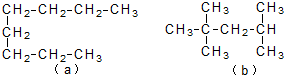
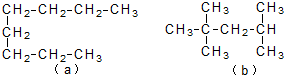
| A. | a和b都不能使酸性KMnO4溶液褪色 | |
| B. | a和b分子中的所有碳碳单键间的键角都相同 | |
| C. | a的沸点比b高 | |
| D. | b脱氢可以形成3种单烯烃分子 |
13.下列说法正确的是( )
| A. | 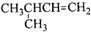 命名为3-甲基丁烯 命名为3-甲基丁烯 | |
| B. | CH3-O-CH3分子在核磁共振氢谱图中只能给出一种信号 | |
| C. | (CH3)3CCH2Cl不能发生消去反应 | |
| D. | 二氟二氯甲烷(CCl2F2)是分子是平面结构 |
17.下列有关有机物的说法正确的是( )
| A. | (NH4)2SO4溶液能使蛋白质变性 | |
| B. | 分子式为C2H4O2的有机物不一定是羧酸 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 纤维素、蛋白质、油脂、葡萄糖在一定条件下都能发生水解反应 |
18.世博园地区改造规划的实施将提升上海的环境质量.位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰.你估计这一空气污染物可能含有( )
| A. | Fe2O3粉尘 | B. | Fe3O4粉尘 | C. | FeO粉尘 | D. | SiO2粉尘 |