题目内容
6.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.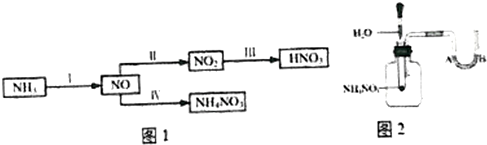
【资料卡片】
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
b.在230℃以上时,同时有弱光:2NH4NO3═2N2↑+O2↑+4H2O
c.在400℃以上时,剧烈分解发生爆炸:4NH4NO3═3N2↑+2NO2↑+8H2O
(1)如图2 将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因NH4NO3溶于水时吸收热量•
(2)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O(填“能”或“不能”)用硝酸铵代替氯化铵.
(3)在汽车发生碰撞时,NaN3会产生N2(填化学式)气体充满安全气囊来减轻碰撞事故中乘员伤害程度.
(4)完成离子反应IV:8NO+7H2O=3NH4++5NO3-+2H+.
分析 (1)依据硝酸铵固体溶解时吸收热量解答;
(2)实验室用加热氯化氨、氢氧化钙固体方法制取氨气,二者加热生成氯化钙、氨气和水,硝酸铵加热容易发生爆炸;
(3)在汽车发生碰撞时,NaN3会产生氮气充满安全气囊来减轻碰撞事故中乘员伤害程度;
(4)分析反应物生成物质中氮元素化合价变化,据此判断反应共同特点;一氧化氮与水反应生成硝酸铵和硝酸,依据化合价升降数目相等及原子个数守恒配平方程式.
解答 解:(1)硝酸铵固体溶解时吸收热量,使瓶内压强减小,所以观察到的A处液面上升,B处液面下降;
故答案为:NH4NO3溶于水时吸收热量;
(2)实验室用加热氯化氨、氢氧化钙固体方法制取氨气,二者加热生成氯化钙、氨气和水,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;硝酸铵加热容易发生爆炸,所以不能用硝酸铵代替氯化铵;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,不能;
(3)在汽车发生碰撞时,NaN3会产生氮气,化学式:N2,充满全气囊来减轻碰撞事故中乘员伤害程度;
故答案为:N2;
(4)一氧化氮与水反应生成硝酸铵和硝酸,反应中+2价的氮部分升高为硝酸根离子中+5价的氮,部分降为铵根离子中-3价的氮,要使得失电子守恒则,铵根离子系数为3,硝酸根离子系数为5,结合原子个数守恒反应的方程式:8NO+7H2O═3NH4++5NO3-+2H+;
故答案为:8;7;3NH4+;5NO3-;2H+.
点评 本题为信息题,明确含氮物质的性质及图框中含氮物质之间的转化、所给信息是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列分子属极性分子的是( )
| A. | H2O | B. | CO2 | C. | BCl3 | D. | NH3 |
3.一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
| A. | 过量的氢气与氮气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
1.某化学兴趣小组设计如下实验方案.将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:

请回答下列问题:
(1)装置B的作用是防倒吸
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应Ⅱ.NaClO不足Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成
下表:(已知酸性:H2SO3>H2CO3>HCl0)

请回答下列问题:
(1)装置B的作用是防倒吸
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应Ⅱ.NaClO不足Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成
下表:(已知酸性:H2SO3>H2CO3>HCl0)
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
| ③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液呈紫色 | Ⅰ或者Ⅲ |
11.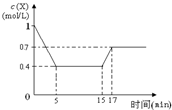 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )| A. | 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) | |
| B. | 15 min时改变的条件可能是减小压强 | |
| C. | 15 min时改变的条件可能是升高温度 | |
| D. | 从初始到17 min时,X的转化率为30% |
18.下列离子方程式书写正确的是( )
| A. | CH3COOH与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 金属钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| D. | 氢氧化钠溶液吸收过量的二氧化碳:2OH-+CO2=CO32-+H2O |
15.下列分子中,所有原子都满足最外层为8电子结构的是( )
| A. | COCl2 | B. | SiH4 | C. | SF6 | D. | PCl5 |
 、
、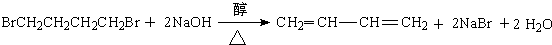 .
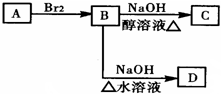
.
 ;C
;C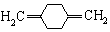 .
.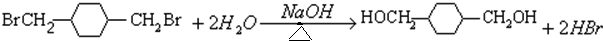 .
.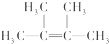 ;
;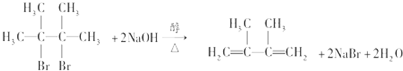 ;
; .
.