题目内容
16.已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1)△H1,2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(1)△H3;
2H2(g)+O2(g)=2H2O(g)△H4
CO(g)+2H2(g)=CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1<0,△H2>0 | B. | 0>△H3>△H4 | ||
| C. | 2△H5+△H1>0 | D. | △H1=△H2+△H3-2△H5 |
分析 A.燃烧反应都是放热反应;
B.生成液态水放出热量多;
C.反应都是放热反应,所以△H5、△H1均为负值;
D.根据盖斯定律分析.
解答 解:A.2CO(g)+O2(g)=2CO2(g)△H2 属于燃烧反应,是放热反应,所以△H2<0,故A错误;
B.2H2(g)+O2(g)=2H2O(1)△H3;2H2(g)+O2(g)=2H2O(g)△H4,从气态水到液态水要放出热量,所以生成液态水放出热量多,由于反应热为负值,所以0>△H4>△H3,故B错误;
C.反应都是放热反应,所以△H5、△H1均为负值,所以2△H5+△H1<0,故C错误;
D.①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1)△H1,
②2CO(g)+O2(g)=2CO2(g)△H2
③2H2(g)+O2(g)=2H2O(1)△H3;
⑤CO(g)+2H2(g)=CH3OH(g)△H5
由盖斯定律①=②+③-2×⑤,即△H1=△H2+△H3-2△H5,故D正确.
故选D.
点评 本题考查了盖斯定律在计算中的应用、反应热大小比较,题目难度不大,注意把握分方程式与目标方程式的关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
10.下列鉴别方法不可行的是( )
| A. | 用水鉴别乙醇、甲苯和硝基苯 | B. | 用燃烧法鉴别甲醇、苯和四氯化碳 | ||
| C. | 用酸性高锰酸钾溶液鉴别苯和甲苯 | D. | 用溴水鉴别乙苯、环己烷和乙醇 |
11.有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,0.1mol乙跟足量的金属钠反应可得到氢气2.24L(标准状况),据此推断甲不可能是( )
| A. | HOCH2CH2CHO | |
| B. | 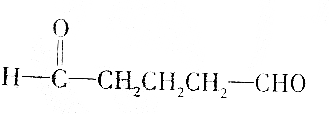 | |
| C. | 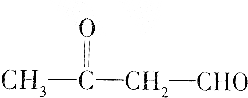 | |
| D. | 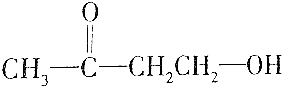 |
4.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数kP=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
11.化学与材料、生活和环境密切相关.下列有关说法中正确的是( )
| A. | 侯氏制碱法是先将CO2通入饱和NaCl溶液后,再通入NH3 | |
| B. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| C. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再利用过滤的方法分离PM2.5微粒和可溶性吸附物 | |
| D. | “神十”航天服是由碳化硅陶瓷和碳纤维复合而制成的,它是一种新型无机非金属材料 |
1.在1L密闭容器发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q kJ•mol-1(Q>0),容器内部分物质的物质的量浓度如表:
下列说法正确的是( )
| 时间/浓度 | c(NH3)(mol•L-1) | c(O2)(mol•L-1) | c(NO)(mol•L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A. | 第4min、第8min时分别达到化学平衡,且平衡常数相同 | |
| B. | 反应在第2min时改变了某一条件,该条件一定是升高温度 | |
| C. | 反应在第2min到第4min时,O2的平均速率为0.1875mol•min-1 | |
| D. | 在开始反应的前2min内,该反应放出0.2QKJ的热量 |
5.某元素最高价氧化物对应水化物的化学式是H3XO4,这种元素的气态氢化物的分子式为( )
| A. | HX | B. | XH3 | C. | H2X | D. | XH4 |
6.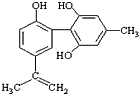 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )| A. | 滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| B. | 1mol该物质分别与浓溴水和H2反应时最多消耗溴水和H2分别为4mol和7mol | |
| C. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| D. | 该分子中的所有碳原子不可能共平面 |