题目内容
1.在1L密闭容器发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q kJ•mol-1(Q>0),容器内部分物质的物质的量浓度如表:| 时间/浓度 | c(NH3)(mol•L-1) | c(O2)(mol•L-1) | c(NO)(mol•L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A. | 第4min、第8min时分别达到化学平衡,且平衡常数相同 | |
| B. | 反应在第2min时改变了某一条件,该条件一定是升高温度 | |
| C. | 反应在第2min到第4min时,O2的平均速率为0.1875mol•min-1 | |
| D. | 在开始反应的前2min内,该反应放出0.2QKJ的热量 |
分析 A.计算第4min的化学平衡常、第8min时达到化学平衡的平衡常,比较二者数值大小;
B.在第2min时改变了某一条件,使反应速率大大加快,改变的条件可能是使用催化剂或升高温度;
C.反应在第2min到第4min时:反应从开始到2min时△c(NH3)=0.2mol/L,所以根据速率之比等于化学方程式计量数之比求算;
D.在开始反应的前2min内,NH3发生反应的物质的量为0.2mol,根据热化学方程式计算该反应放出0.05QKJ的热量.
解答 解:A.第4min的化学平衡常K1=$\frac{{c}^{4}(NO)•{c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})•{c}^{5}({O}_{2})}$=$\frac{0.{5}^{4}×0.{5}^{6}}{0.{3}^{4}×0.97{5}^{5}}$、第8min时达到化学平衡的平衡常数K2=$\frac{{c}^{4}(NO)•{c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})•{c}^{5}({O}_{2})}$=$\frac{0.{1}^{4}×0.{1}^{6}}{0.{7}^{4}×1.47{5}^{5}}$,二者二者数值不相等,故A错误;
B.反应从开始到2min时△c(NH3)=0.2mol/L,所以根据方程式中与氧气的关系,氧气的浓度改变数值为5/4×0.2mol/L=0.25mol/L.因此a=1.35mol/L.在第2min时改变了某一条件,使反应速率大大加快,改变的条件可能是使用催化剂或升高温度,故B错误;
C.反应在第2min到第4min时:
V(NH3)=(0.6-0.3)mol/L÷2min=0.15mol/(L•min);
V(O2)=“5/4”V(NH3)=5/4×0.15mol/(L•min)=0.1875mol/(L•min),故C正确;
D.在开始反应的前2min内,NH3发生反应的物质的量为0.2mol.根据热化学方程式可知:该反应放出0.05QKJ的热量,故D错误.
故选:C.
点评 本题考查较为综合,涉及化学平衡的计算和判断,侧重于学生的分析能力和计算能力的考查,为高考常见题型,难度较大.

2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(1)△H3;
2H2(g)+O2(g)=2H2O(g)△H4
CO(g)+2H2(g)=CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1<0,△H2>0 | B. | 0>△H3>△H4 | ||
| C. | 2△H5+△H1>0 | D. | △H1=△H2+△H3-2△H5 |
| A. | ①② | B. | ②③ | C. | ③ | D. | ② |
| A. | 不用稀硫酸改用98%的浓硫酸 | B. | 加热 | ||
| C. | 滴加CuSO4溶液 | D. | 不用铁片改用铁粉 |
 表示的分子式C7H12;名称是3-甲基-2,4-己二烯.
表示的分子式C7H12;名称是3-甲基-2,4-己二烯.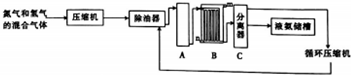
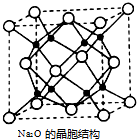 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题: