题目内容
用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.判断下列说法正确的是( )
反应A:4HCl+O2
2Cl2+2H2O
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、
反应A:4HCl+O2
| CuO?CuCl2 |
| 400℃ |
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、

| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
考点:反应热和焓变
专题:
分析:A、反应A中,4mol HCI被氧化,放出115.6kJ的热量;
B、反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差;
C、据B分析;
D、由反应Ⅱ判断,氧气能够将氯氧化为氯气.
B、反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差;
C、据B分析;
D、由反应Ⅱ判断,氧气能够将氯氧化为氯气.
解答:
解:A、反应A的△H=-115.6kJ/mol,故A错误;
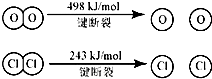
B、E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,
反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:
4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,
整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,故B正确;
C、据B分析,故C错误;
D、由反应Ⅱ判断,氧气能够将氯氧化为氯气,氯元素的非金属性比氧元素弱,故D错误;
故选B.
B、E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,
反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:
4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,
整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,故B正确;
C、据B分析,故C错误;
D、由反应Ⅱ判断,氧气能够将氯氧化为氯气,氯元素的非金属性比氧元素弱,故D错误;
故选B.
点评:本题考查了焓变、焓变等于反应物的键能和减去生成物的键能和、氧化剂的氧化性大于氧化产物,题目难度中等.

练习册系列答案
相关题目
下列各化学式中,只表示一种纯净物的是( )
| A、C2H4O2 |
| B、C3H6 |
| C、C2H3Br |
| D、C3H6O |
下列物质中,只有在溶液中才能导电的电解质是( )
| A、NaCl |
| B、酒精 |
| C、H2SO4 |
| D、SO3 |
下列无机含氧酸酸性最弱的是( )
| A、HClO |
| B、H3PO4 |
| C、HNO3 |
| D、HClO4 |
有关原电池和电解池的下列说法中不正确的是( )
| A、原电池负极发生氧化反应 |
| B、电解池阳极发生还原反应 |
| C、通电后,电解池中阳离子向阴极移动 |
| D、原电池中电子从负极沿导线流向正极 |
下列物质的水溶液中,其电离方程式正确的是( )
| A、H2SO4=H2++SO42- |
| B、NaHSO4=Na++HSO4- |
| C、Na2CO3=2Na++CO32- |
| D、Ca(OH)2=Ca2++OH- |
下列表示物质结构的化学用语或模型图正确的是( )
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: |
 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答: