题目内容
17. 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:(一)实验室制备过程:
FeSO4溶液$→_{①}^{NaClO_{3}/80℃}$Fe2(SO4)3$→_{②}^{NH_{3}H_{2}O}$Fe(OH)3↓$→_{③}^{C_{6}H_{5}O_{7}H_{3}}$Fe(C6H5O7)$→_{④}^{氨水}$(NH4)3Fe(C6H5O7)2
(二)工业生产流程:
硫酸亚铁$→_{①}^{氯化钠}$氢氧化铁$→_{②}^{柠檬酸}$成盐$→_{③}^{氨水/柠檬酸}$溶液$\stackrel{过滤}{→}$滤液→…$\stackrel{洗涤}{→}$ $\stackrel{干燥}{→}$成品
已知:
Fe(OH)3+C6H5O7H3(柠檬酸)═Fe(C6H5O7)(柠檬酸铁)+3H2O
3NH3•H2O+C6H5O7H3(柠檬酸)═(NH4)3C6H5O7(柠檬酸铵)+3H2O
Fe(C6H5O7)+(NH4)3C6H5O7═(NH4)3Fe(C6H5O7)2(柠檬酸铁铵)
请回答下列问题:
(一)实验室制备过程中,高纯度、合适紧密结构的氢氧化铁制备是生成柠檬酸铁铵的关键步骤:
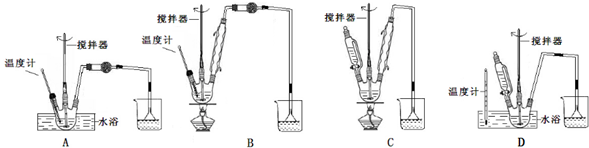
(1)第①步中氯酸钠氧化硫酸亚铁时,下列装置最适合的是D.
(2)若要检验第①步反应后的溶液中不存在Fe2+,下列试剂最合适的是D.
A.KSCN溶液 B.KSCN溶液和氯水
C.酸性高锰酸钾溶液 D.铁氰化钾溶液
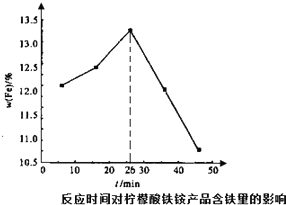
(3)第②步中反应时间与产品的含铁量的关系如图所示,在26min后含铁量随着反应时间的延长而降低,其主要原因是反应时间过长,产生结构紧密的氢氧化铁,难以被柠檬酸溶解,导致产品含铁量降低.请分析26min前含铁量随着反应时间的延长而增加的主要原因是26min前随着滴加时间的延长氨水与硫酸铁反应更充分,产生更多结构合适易被柠檬酸溶解的氢氧化铁,从而增加含铁量.
(4)检验氢氧化铁是否完全洗涤干净的具体实验操作是取少量最后一次洗涤液于2支试管中,分别滴加酸化的BaCl2、AgNO3溶液,均无白色沉淀产生,证明洗涤干净.
(二)在工业生产流程中
(5)下列关于工业生产流程的说法正确的是AC.
A.第①步用大量的NaClO3氧化Fe2+时,可消耗H+,促进产生的Fe3+水解产生Fe(OH)3
B.第①步中的NaClO3可以用稀硝酸溶液代替
C.第②步中为加快Fe(OH)3的溶解速率,可采用搅拌或适当升高温度
D.第③步中的柠檬酸是起调节溶液pH作用,可用稀硫酸代替
(6)第④步后,为制得成品,后续操作步骤是蒸发浓缩、冷却结晶、过滤.
(7)在室温下,将所得的成品用无水乙醇进行浸泡2次,从而得到精制产品,选择用无水乙醇进行浸泡的优点是①无水乙醇可溶解柠檬酸等有机杂质,提高产品纯度;②减少柠檬酸铁铵的溶解损失;③乙醇易挥发,不易残留.(写出两点)
分析 柠檬酸铁铵制备:在酸性条件下氯酸钠氧化硫酸亚铁,反应方程式为:NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O,加入氨水,硫酸铁和一水合氨发生复分解反应生成氢氧化铁沉淀和硫酸铵,反应方程式为:Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4,加入柠檬酸发生Fe(OH)3+C6H5O7H3(柠檬酸)═Fe(C6H5O7)(柠檬酸铁)+3H2O,加入氨水,发生3NH3•H2O+C6H5O7H3(柠檬酸)═(NH4)3C6H5O7(柠檬酸铵)+3H2O,Fe(C6H5O7)+(NH4)3C6H5O7═(NH4)3Fe(C6H5O7)2(柠檬酸铁铵),制得柠檬酸铁铵.
(一)(1)氯酸钠氧化硫酸亚铁,需温度控制在80℃,比较装置的异同以及反应的条件选择所需仪器;
(2)亚铁离子可以用KSCN溶液和氯水、高锰酸钾溶液、K3[Fe(CN)6]检验,比较;
(3)根据题干信息:反应时间过长,产生结构紧密的氢氧化铁,难以被柠檬酸溶解进行解答;
(4)氢氧化铁未完全洗涤干净,含有杂质离子硫酸根离子,根据硫酸根离子的检验方法进行检验;
(二)(5)A.铁离子水解生成氢氧化铁和氢离子,NaClO3氧化Fe2+,消耗H+,促进产生的Fe3+水解;
B.硝酸具有强氧化性,能氧化产物氯离子生成氯气,同时引入杂质离子;
C.大多数固体溶解度随着温度的升高而升高;
D.稀硫酸能和氢氧化铁反应;
(6)从溶液中获取固体溶质,通常采用蒸发浓缩、冷却结晶、过滤,洗涤干燥得到成品;
(7)无水乙醇属于常用的有机溶剂,易挥发.
解答 解:(一)(1)A.在酸性条件下氯酸钠氧化硫酸亚铁,反应方程式为:NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O,氯酸钠氧化硫酸亚铁,无需球形干燥管进行干燥,故A错误;
B.氯酸钠氧化硫酸亚铁,需温度控制在80℃,装置B用酒精灯加热,不便于控制温度,反应中无需用冷凝管冷凝反应物、产物,故B错误;
C.氯酸钠氧化硫酸亚铁,需温度控制在80℃,装置C无温度计,故C错误;
D.用温度计控制水浴的温度,符合氯酸钠氧化硫酸亚铁80℃的要求,因需酸化,图中左部分有加液器需加硫酸,有防止倒吸的装置,防止副产物二氧化硫等易溶于水的物质溶于水产生倒吸,符合条件,故D正确;
故答案为:D;
(2)亚铁离子与KSCN溶液不反应,先加KSCN溶液,无现象,再加氯水变红,可检验亚铁离子,酸性高锰酸钾溶液能被亚铁离子还原而使酸性高锰酸钾溶液褪色,可检验亚铁离子,亚铁离子和铁氰化钾反应3Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,生成蓝色沉淀,所以亚铁离子可以用K3[Fe(CN)6]检验,现象最明显,D最合适,
故答案为:D;
(3)加入氨水,硫酸铁和一水合氨发生复分解反应生成氢氧化铁沉淀和硫酸铵,反应方程式为:Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4,26min前随着滴加时间的延长氨水与硫酸铁反应更充分,产生更多结构合适易被柠檬酸溶解的氢氧化铁,从而增加含铁量,
故答案为:26min前随着滴加时间的延长氨水与硫酸铁反应更充分,产生更多结构合适易被柠檬酸溶解的氢氧化铁,从而增加含铁量;
(4)硫酸铁和一水合氨发生复分解反应生成氢氧化铁沉淀和硫酸铵,氢氧化铁未完全洗涤干净,含有杂质离子硫酸根离子,检验氢氧化铁是否完全洗涤干净,取少量最后一次洗涤液于2支试管中,分别滴加酸化的BaCl2、AgNO3溶液,均无白色沉淀产生,证明洗涤干净,
故答案为:取少量最后一次洗涤液于2支试管中,分别滴加酸化的BaCl2、AgNO3溶液,均无白色沉淀产生,证明洗涤干净;
(二)(5)A.Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,第①步用大量的NaClO3氧化Fe2+时,可消耗H+,促进产生的Fe3+水解产生Fe(OH)3,故A正确;
B.第①步中的NaClO3,若用稀硝酸溶液代替,稀硝酸氧化产物中的氯离子生成氯气,硫酸铁中混有硝酸铁,故B错误;
C.采用搅拌可加快固体溶解,适当升高温度也能加快Fe(OH)3的溶解速率,故C正确;
D.第③步中的柠檬酸是起调节溶液pH作用,不用稀硫酸代替,因稀硫酸能和氢氧化铁发生中和反应,故D错误;
故答案为:AD;
(6)柠檬酸铁铵溶于水,见光易转化为亚铁盐,通常采用蒸发浓缩、冷却结晶、过滤,洗涤干燥得到成品,
故答案为:蒸发浓缩、冷却结晶、过滤;
(7)在室温下,将所得的成品用无水乙醇进行浸泡2次,从而得到精制产品,选择用无水乙醇进行浸泡是因为:①无水乙醇可溶解柠檬酸等有机杂质,提高产品纯度;②减少柠檬酸铁铵的溶解损失;③乙醇易挥发,不易残留,
故答案为:①无水乙醇可溶解柠檬酸等有机杂质,提高产品纯度;②减少柠檬酸铁铵的溶解损失;③乙醇易挥发,不易残留.
点评 本题考查柠檬酸铁铵的制备、实验原理的分析及混合物的分离与提纯等实验基本操作,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0mL | 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol•L-1NaOH溶液:再滴加1.5mL1.0mol•L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol•L-1AlCl3溶液 | Ⅱ.加碱时出现白色沉淀,又逐渐溶解直至消失;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol•L-1Fe(NO3)2溶液 | Ⅲ.加碱时生成白色沉淀迅速变成灰绿色,最后变成红褐色;加酸后溶液变为黄色 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(2)II中加碱时出现的现象是出现白色沉淀,又逐渐溶解直至消失,此现象说明溶液中发生反应的离子方程式是Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(3)III中加碱时出现的现象是生成白色沉淀迅速变成灰绿色,最后变成红褐色.
(4)用离子方程式解释IV中加碱时出现的现象:Cl2+2OH-═ClO-+Cl-+H2O.
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0 mL | 0.1 mol•L-1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol•L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol•L-1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
向1.0mL 0.1mol•L-1Fe(NO3)2溶液中滴加KSCN溶液,没有明显现象,再向其中滴加1.5mL1.0mol•L-1H2SO4溶液,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1mol•L-1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b.4Fe2++O2+4H+═4Fe3++2H2O(用离子方程式表示).
| A. | CO、H2S的转化率之比为1:1 | |
| B. | 达平衡后H2S的体积分数为29.4% | |
| C. | 升高温度,COS浓度减小,表明该反应是吸热反应 | |
| D. | 恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动 |

已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
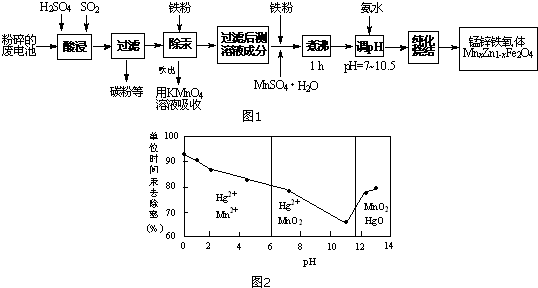
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种)增大硫酸浓度或升高温度或边加硫酸边搅拦或增加浸出时间等.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计(或者酸度计或试纸).
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C.
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值.
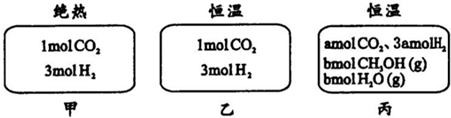
| A. | 刚开始反应时速率:甲<乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
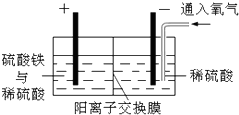 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示: