题目内容
12.下列叙述中,能证明Li金属比Mg金属活泼性强的是( )| A. | Li原子的最外层电子数比Mg原子的最外层电子数少 | |
| B. | Mg原子的电子层数比Li原子电子层数多 | |
| C. | 1 mol Mg从酸中置换出的H2比1 mol Li从酸中置换出的H2多 | |
| D. | 氢氧化锂的碱性比氢氧化镁强 |
分析 金属的金属性越强,其单质的还原性越强,其单质与水或酸反应越剧烈,其最高价氧化物的水化物碱性越强,据此分析解答.
解答 解:A.金属的金属性强弱与失电子难易程度有关,与元素最外层电子数多少无关,所以该选项不能比较金属性强弱,故A错误;
B.金属的金属性强弱与失电子难易程度有关,与电子层数无关,所以不能比较金属性强弱,故B错误;
C.金属的金属性强弱与失电子难易程度有关,与失电子多少无关,故C错误;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,氢氧化锂的碱性比氢氧化镁强,则说明金属性Li>Mg,故D正确;
故选D.
点评 本题考查金属性强弱判断,为高频考点,侧重考查学生分析判断及知识综合运用能力,明确金属性强弱与失电子难易程度关系是解本题关键,与失电子多少无关,易错选项是C.

练习册系列答案
相关题目
13.“玉兔”号月球车用${\;}_{94}^{238}$Pu作为热源材料.下列关于${\;}_{94}^{238}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu最外层电子数相同 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U化学性质完全相同 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 |
3.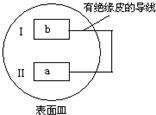 把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
 把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )| A. | a是原电池的负极 | B. | b的活泼性大于a | ||
| C. | 无电流产生 | D. | b 电极上有气泡产生 |
7.下列说法正确的是( )
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 因为氧化铁是一种碱性氧化物,所以常用作红色油漆和涂料 |
17.下列关于pH值的叙述正确的是( )
| A. | 常温下,4体积pH=9的Ca(OH)2溶液与1体积pH=13的NaOH溶液混合后,氢离子浓度是1×10-13mol/L | |
| B. | 用盐酸滴定氨水时,能用酚酞做指示剂(酚酞的变色范围是pH=8~10) | |
| C. | 加热Na2CO3溶液、NaHCO3溶液和CO2与H2O饱和溶液,它们的pH值都会上升 | |
| D. | pH相同的氨水、氢氧化钠用蒸馏水稀释到原来的x倍、y倍至pH仍相同,则x<y |
1.有人用全钒液流电池:VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢,电解总方程式为3H2O+3O2═3H2O2+O3,其中H2O2只为还原产物.下列说法正确的是( )
| A. | 原电池放电时正极反应为VO2++2H++e-═VO2++H2O | |
| B. | 充电时阴极反应为V2+-e-═V3+ | |
| C. | 电解池的阴极反应式为3O2+6H2O+6e-═3H2O2+6OH- | |
| D. | 电解池中生成22.4 L O3(标准状况)时,转移3 mol电子 |