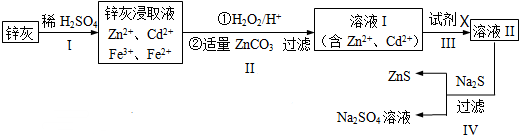
题目内容
2.氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下: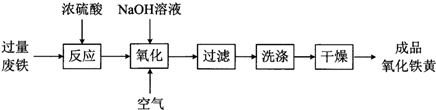
(1)氧化铁黄中铁元素的化合价为+3,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是CO32-+H2O?HCO3-+OH-(写离子方程式).
(2)氧化过程生成氧化铁黄的化学方程式是4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O.
(3)上述流程中,检验“洗涤”是否完全的方法是取最后一次洗涤液,加入少量氯化钡溶液,后加入适量稀盐酸,如未观察到白色沉淀,即可证明洗干净.
(4)氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是PH过低导致氧化铁黄部分溶于酸.
(5)取1g样品进行纯度测试,将其溶解于足量稀盐酸中,后用一定浓度的过量NaOH溶液沉淀其中的铁元素,得到沉淀的质量为Bg,试用所给数据求出产品的纯度$\frac{89B}{107}$$\frac{(\;\;\;\;)}{(\;\;\;\;)}×$100%.
分析 过量废铁加入浓硫酸加热溶解得到硫酸亚铁溶液,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄,
(1)废铁表面由防锈的油污,碳酸钠溶液水解显碱性,油脂会在碳酸钠溶液中水解;
(2)流程分析可知过量铁粉和浓硫酸加热反应生成硫酸亚铁,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,结合原子守恒和电子守恒配平书写化学方程式;
(3)检查洗涤液中是否含有硫酸根离子设计实验检验是否洗涤干净;
(4)FeOOH可与酸反应生成盐和水;
(5)FeOOH加入盐酸生成氯化铁,然后加入氢氧化钠反应生成氢氧化铁.
解答 解:过量废铁加入浓硫酸加热溶解得到硫酸亚铁溶液,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄,
(1)FeOOH种O为-2价,H为+1价,则Fe为+3价,废铁表面由防锈的油污,碳酸钠溶液水解显碱性,油脂会在碳酸钠溶液中水解,易于洗涤,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是:CO32-+H2O?HCO3-+OH-,
故答案为:+3;CO32-+H2O?HCO3-+OH-;
(2)流程分析可知过量铁粉和浓硫酸加热反应生成硫酸亚铁,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,同时生成硫酸钠和水,结合原子守恒和电子守恒配平书写化学方程式为:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O,
故答案为:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O;
(3)检查洗涤液中是否含有硫酸根离子设计实验检验是否洗涤干净,检验洗涤是否完全的方法是,取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净,
故答案为:取最后一次洗涤液,加入少量氯化钡溶液,后加入适量稀盐酸,如未观察到白色沉淀,即可证明洗干净;
(4)氧化时应控制pH的合理范围是保证产率最高,此时的PH范围为:3.5~4.0,pH过小导致产率较低是酸性增强,氧化铁黄会溶解于酸中,
故答案为:PH过低导致氧化铁黄部分溶于酸;
(5)FeOOH加入盐酸生成氯化铁,然后加入氢氧化钠反应生成氢氧化铁,
反应的关系式为FeOOH~Fe(OH)3,
89 107
x Bg
x=$\frac{89B}{107}$g,
则纯度为$\frac{89B}{107}$$\frac{(\;\;\;\;)}{(\;\;\;\;)}×$100%,
故答案为:$\frac{89B}{107}$$\frac{(\;\;\;\;)}{(\;\;\;\;)}×$100%.
点评 本题考查了物质的分离和提纯,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握流程分析判断,主要是物质性质的理解应用,注意实验基本操作的掌握,题目难度中等.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | Li原子的最外层电子数比Mg原子的最外层电子数少 | |
| B. | Mg原子的电子层数比Li原子电子层数多 | |
| C. | 1 mol Mg从酸中置换出的H2比1 mol Li从酸中置换出的H2多 | |
| D. | 氢氧化锂的碱性比氢氧化镁强 |
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
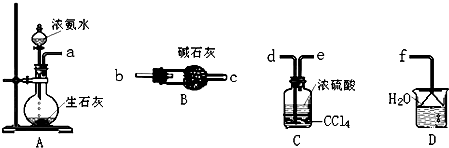
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.
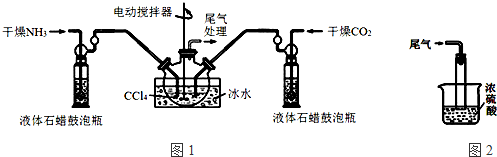
注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
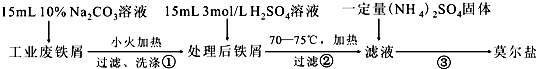
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液中加入足量的铁粉,
③过滤,滤液中滴加NaOH溶液调节反应液的pH约为5,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
| A. | 离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用 | |
| B. | 离子化合物中的阳离子都是金属离子 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 凡是金属元素跟非金属元素化合都形成离子化合物 |

 .
.