题目内容
1.有人用全钒液流电池:VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢,电解总方程式为3H2O+3O2═3H2O2+O3,其中H2O2只为还原产物.下列说法正确的是( )| A. | 原电池放电时正极反应为VO2++2H++e-═VO2++H2O | |
| B. | 充电时阴极反应为V2+-e-═V3+ | |
| C. | 电解池的阴极反应式为3O2+6H2O+6e-═3H2O2+6OH- | |
| D. | 电解池中生成22.4 L O3(标准状况)时,转移3 mol电子 |
分析 A.放电时电池反应式为VO2++V2++2H+=VO2++H2O+V3+,正极上VO2+得电子发生还原反应;
B.充电时电池反应式为VO2++H2O+V3+=VO2++V2++2H+,阴极上V3+得电子发生还原反应;
C.电解池中阳极反应为3H2O-6e-=O3+6H+,阴极反应为6H++3O2+6e-=3H2O2;
D.电解池中生成标况下22.4L臭氧即生成1mol臭氧时,根据臭氧和转移电子之间的关系式计算转移电子数.
解答 解:A.放电时电池反应式为VO2++V2++2H+=VO2++H2O+V3+,正极上VO2+得电子发生还原反应,正极反应式为VO2++2H++e-═VO2++H2O,故A正确;
B.充电时电池反应式为VO2++H2O+V3+=VO2++V2++2H+,阴极上V3+得电子发生还原反应,电极反应式为V3++e-═V2+,故B错误;
C.电解质溶液呈酸性,所以阴极不能有 OH-生成,阴极反应为6H++3O2+6e-=3H2O2,故C错误;
D.电解池中生成标况下22.4L臭氧即生成1mol臭氧时,根据3H2O+3O2═3H2O2+O3知,转移6mol电子,故D错误;
故选A.
点评 本题考查原电池和电解池原理,为高频考点,侧重考查学生分析判断能力,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,易错选项是D.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
11.下列叙述中错误的是( )
| A. | 随着电子层数增多,碱金属的原子半径逐渐增大 | |
| B. | 碱金属具有强还原性,它们的离子具有强氧化性 | |
| C. | 碱金属单质的熔沸点随着核电荷数的增大而降低 | |
| D. | 碱金属元素在自然界中都是以化合态存在的 |
12.下列叙述中,能证明Li金属比Mg金属活泼性强的是( )
| A. | Li原子的最外层电子数比Mg原子的最外层电子数少 | |
| B. | Mg原子的电子层数比Li原子电子层数多 | |
| C. | 1 mol Mg从酸中置换出的H2比1 mol Li从酸中置换出的H2多 | |
| D. | 氢氧化锂的碱性比氢氧化镁强 |
9.下列粒子半径大小比较,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | Cl>S>F>O | D. | S2->O2->Cl->Br- |
16.在下列有机物分子中,核磁共振氢谱中给出的信号峰数目相同的一组是( )
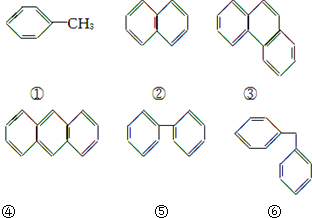

| A. | ①⑤ | B. | ②④ | C. | ④⑤ | D. | ⑤⑥ |
6.氢气还原氧化铜的反应为:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,在该反应中( )
| A. | CuO作还原剂 | B. | CuO作氧化剂 | ||
| C. | 铜元素化合价降低 | D. | 氢元素化合价升高 |
13.能正确表示下列反应的离子方程式是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
11.下列说法正确的是( )
| A. | 离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用 | |
| B. | 离子化合物中的阳离子都是金属离子 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 凡是金属元素跟非金属元素化合都形成离子化合物 |