题目内容
3.某化学兴趣小组制备硫化亚铁并探究其自燃性质.实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.
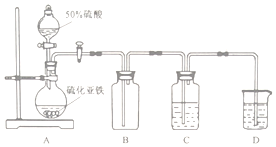
(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
分析 实验I:用灼热的玻璃棒触及硫粉和铁粉的混合物,热玻璃棒起加热作用,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS,说明FeS在常温下能稳定存在,故该实验制得的硫化亚铁不能自燃;
实验II:A装置制备硫化氢气体,B装置为安全瓶,起缓冲作用,C装置由硫化氢与硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液反应制备硫化亚铁:H2S+Fe2+=FeS↓+2H+,D装置吸收尾气,
(3)B装置为安全瓶,起缓冲作用;
(4)硫化氢与亚铁离子反应制备硫化亚铁;
(5)硫化亚铁晶体附着硫酸根离子,检验洗涤液中是否混有硫酸根离子即可;
(6)产品中混有三家铁,总铁质量分数大于亚铁质量分数,根据亚铁的质量分数计算硫化亚铁的质量,由此计算其质量分数得x;
(7)硫化亚铁在常温下能发生缓慢氧化而自燃,生成氧化铁和二氧化硫.
解答 解:(1)用灼热的玻璃棒触及硫粉和铁粉的混合物,当混合物呈红热状态时,移开玻璃棒,说明该反应为放热反应,热的玻璃棒加热引发铁与硫发生反应;
故答案为:加热引发铁与硫发生反应;
(2)该反应为放热反应,该过程中FeS在常温下能稳定存在,故故该实验制得的硫化亚铁不能自燃;
故答案为:不能;
(3)B装置为安全瓶,起缓冲作用;
故答案为:缓冲瓶(或安全瓶);
(4)硫化氢与硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液反应制备硫化亚铁,离子方程式为:H2S+Fe2+=FeS↓+2H+;
故答案为:H2S+Fe2+=FeS↓+2H+;
(5)硫化亚铁晶体附着硫酸根离子,检验洗涤液中是否混有硫酸根离子,方法为:取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净;
故答案为:取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净;
(6)①设产品总质量为100g,则亚铁质量为38.50g,故FeS中硫元素的质量为$\frac{38.50}{56}×32$g=22g,故FeS的质量为38.50g+22g=60.50g,故硫化亚铁质量分数x%=$\frac{60.50}{100}×100%$=60.50%,x=60.50;
故答案为:60.50;
②产品中混有三家铁,总铁质量分数大于亚铁质量分数;
故答案为:产品中含有三价铁杂质;
(7)硫化亚铁在常温下能发生缓慢氧化而自燃,生成氧化铁和二氧化硫,反应为:4FeS+7O2=2Fe2O3+4SO2;
故答案为:4FeS+7O2=2Fe2O3+4SO2.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、物质含量的计算等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 0.1mol•L-1NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 使紫色石蕊试纸变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:K+、SO42-、Na+、ClO- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
| A. | Na、Mg、Al | B. | N、P、As | C. | P、Si、Al | D. | C、Si、P |
| A. | SiO2→H2SiO3 | B. | Na2O2→Na2CO3 | C. | Cu→Cu2(OH)2CO3 | D. | AlCl3→Al(OH)3 |
4H3(g)+5O2(g)?4NO(g)+6H2O(g)
下列条件下,反应速率最快的是( )
| 选项 | 温度 | 催化剂 | NH3(g)浓度 |
| A | 500℃ | 铂金合金网 | 2mol/L |
| B | 500℃ | 无 | 1mol/L |
| C | 800℃ | 铂铑合金网 | 2mol/L |
| D | 800℃ | 铂铑合金网 | 1mol/L |
| A. | A | B. | B | C. | C | D. | D |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6 min时,c(H2O2)=0.20mol/L | |
| B. | 反应至6 min时,H2O2分解了40% | |
| C. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol•L-1•min-l | |
| D. | 6~10 min的平均反应速率:可(H2O2)<3.3×10-2mol•L-1•min-l |
| A. | 化学基本反应类型包括化合反应、分解反应、置换反应和复分解反应四种 | |
| B. | 六大基本营养素是蛋白质、糖类、油脂、维生素、无机盐和水 | |
| C. | 由同种元素组成的物质一定是纯净物 | |
| D. | 遇到火灾时,用湿毛巾捂住口鼻,匍匐逃离火灾现场 |

| A. | 元素X的单质是一种常见的半导体材料 | |
| B. | M和Y的最高价氧化物对应的水化物之间能互相反应 | |
| C. | Y的最高价氧化物对应水化物的酸性比X 的弱 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定 |
| A. | 需加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应都不需要加热就能发生 | |
| C. | 化学反应的过程中一定有物质变化,可以没有能量变化 | |
| D. | 化学反应是放热还是吸热,取决取反应物具有的总能量和生成物具有的总能量的相对大小 |