题目内容
13.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 0.1mol•L-1NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 使紫色石蕊试纸变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:K+、SO42-、Na+、ClO- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
分析 A.硫酸氢铵电离出的硫酸根离子与钡离子结合生成硫酸钡沉淀;
B.该溶液呈酸性,硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;
C.该溶液具有氧化性,四种离子之间不反应,也不易被氧化;
D.该溶液中存在大量氢离子或氢氧根离子,碳酸根离子与氢离子反应.
解答 解:A.SO42-、Ba2+反应生成硫酸钡沉淀,在溶液中不能大量共存,故A错误;
B.使紫色石蕊试纸变红的溶液呈酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.使淀粉碘化钾试纸变蓝的溶液具有氧化性,K+、SO42-、Na+、ClO-之间不反应,也不会被氧化,在溶液中能够大量共存,故C正确;
D.与铝反应产生大量氢气的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,CO32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列各组物质不互为同分异构体的是( )
| A. | 蔗糖与麦芽糖 | B. | 蛋白质和氨基酸 | C. | 乙酸与甲酸甲酯 | D. | 淀粉和纤维素 |
1.下列各物质的名称、化学式和分类均正确的是( )
| A. | 氧化钠(NaO)属于碱性氧化物 | B. | 氯化钙(CaCl)属于盐 | ||
| C. | 硫酸(H2SO3)属于酸 | D. | 葡萄糖(C6H12O6)属于有机物 |
8.下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 由水电离出的c(OH-)=1×10-12mol/L的溶液中:Na+、Mg2+、SO42-、Cl- | |
| B. | 能使甲基橙由橙色变为红色的溶液中:Cu2+、Al3+、NO3-、Br- | |
| C. | 加入Zn 能放出H2的溶液中:K+、Ba2+、Cl-、AlO2- | |
| D. | pH=12的溶液中:Ba2+、NH4+、NO3-、Cl- |
18.下图是部分矿物资源的利用及产品流程,有关说法不正确的是( )


| A. | 电解冶炼铝时产生副产物不处理可导致温室效应 | |
| B. | 粗硅制高纯硅时,提纯四氯化硅可用过滤、分馏的方法 | |
| C. | 黄铜矿冶铜时,将矿石粉碎以提高生产效率 | |
| D. | 上述生产过程既涉及氧化还原反应,又涉及非氧化还原反应 |
5.下列能级的能量大小比较,正确的是( )
| A. | E(4s)>E(3d) | B. | E(6p)>E(5f) | C. | E(6s)<E(5p) | D. | E(4d)<E(5p) |
2.下列化学用语正确的是( )
| A. | CCl4的电子式: | B. | Na2S的形成过程: | ||
| C. | CO2分子的电子式: | D. | 过氧化氢分子的结构式:H-O-O-H |
3.某化学兴趣小组制备硫化亚铁并探究其自燃性质.
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.
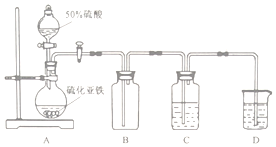
(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
①表中x=60.50
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.

(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).